肝類器官
肝臟在調節能量平衡和藥物代謝過程中起著重要的作用,它能產生包括膽汁在內的人體所需的數千種物質和酶,并能解毒各種有毒物質。藥物引起的肝中毒與肝的代謝密切相關,肝臟研究一直是專家們研究的熱點。
雖然肝臟細胞在人體內再生能力不受限制,但如果脫離人體環境只能存活2-3天,肝細胞獨特的再生功能也會消失。隨著細胞生物學的迅速發展,研究發現3D培養體系可以顯著促進肝細胞體外成熟功能,提供了肝細胞的空間位置、壓力信號和基質粘附信息,在肝細胞的生存和功能中起重要作用。
肝臟類器官能更好地模擬肝臟的代謝和合成功能,如糖原代謝、脂質代謝、類固醇代謝、藥物代謝、白蛋白分泌、尿素合成等,并能高度表達肝細胞相關藥物代謝酶、核受體和肝臟特異性標志物,例如ALB, AAT, HNF-4α, HNF-3β等。
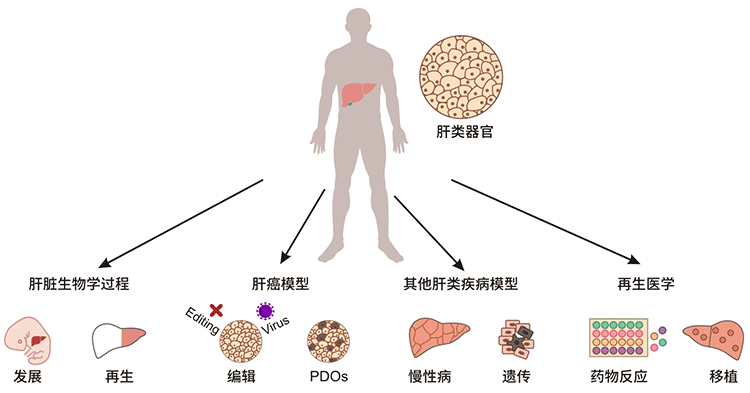
圖1. 腎類器官的應用
1、肝臟類器官的研究
來自健康供體的肝臟類器官是了解肝臟發育和再生等肝臟生物學過程、模擬肝癌和其他肝臟疾病(如慢性和遺傳性疾病)以及應用于再生醫學(包括藥物反應和移植)的理想模型。基因編輯、病毒感染和藥物引入肝臟類器官可以模擬疾病的發生和發展過程。正常肝臟類器官是臨床藥物篩選、轉化研究以及解毒和代謝研究的理想模型。來自患病樣本的類器官,包括癌癥類器官,概括了患者的原始特征。
| 肝類器官的來源 | 作用 |
|---|---|
| iPSC | 分泌白蛋白,藥物代謝強 |
| MSC | 肝臟標志化合物的早期表達 |
| iPSC, matrix cell | 肝臟特異性基因表達,白蛋白和尿素分泌,細胞色素P450活性 |
| iPSC, SWISS, 3T3 cell | 肝細胞相關基因表達、白蛋白分泌、尿素生成 |
| MSC, HUVEC | 肝臟特異性基因表達及白蛋白分泌 |
| Hepatocyte | 白蛋白分泌,肝臟特異性基因高表達 |
| Hepatoma carcinoma cell, MSC, HUVEC | 肝臟特異性基因的高表達和尿素的形成 |
| iPSC, MSC, HUVEC | 白蛋白、管狀蛋白和其他與緊密連接相關的功能標志物的高表達 |
| Hepatocyte, MSC, HUVEC | 肝臟特異蛋白表達及白蛋白分泌 |
| Hepatocyte, MSC, colon cancer HCT116 cell | 白蛋白分泌,尿素生成 |
| Hepatoma carcinoma cell | 血管生成生長因子高表達 |
2、肝細胞研究進展
2013年,Takebe等人使用 iPSC 產生的類肝細胞與人的臍靜脈內皮細胞一級人骨髓間充質干細胞在 Matrigel 涂層板上共同培養,生成類似于人肝芽組織的 3D 聚合物,這是 iPSC 衍生的的第一個肝細胞類器官原型。 2013 年,Hans Clevers 等人對人類肝臟類器官進行了首次研究。他們發現,通過激活Wnt信號通路,利用Lgr5+肝干細胞,可以成功構建肝類器官。并通過分化和移植實驗證明這些肝臟類器官具有肝細胞的功能活性[1]。構建的肝臟類器官雖然只具備肝臟的部分基本功能,但為后續研發奠定了基礎。
2016年,馬宣義等利用3D生物打印技術構建了ipsc衍生的肝類器官[2]。
肝癌類器官于 2017 年應用于疾病建模和藥物篩選 [3]。肝臟是一個功能復雜的多細胞器官,單細胞類器官不能完全概括肝臟功能。 2017 年,Guan 等人。首次使用 iPSCs 實現肝膽細胞的共分化,從而產生肝膽類器官。在同一時期,Laura Broutier 等人。從肝癌患者的肝癌組織中成功培養出8個原發性肝癌(PLC)類器官。該模型不僅可以包含親本腫瘤的組織結構、表達譜、基因組譜系和體內致瘤性,還可以作為生物標志物鑒定和藥物篩選的模型。它直接表明類器官可用于識別肝癌新治療靶點的基因和潛在預后價值。
2018年,胡等人利用原發性肝組織培養具有小膽管結構的肝臟類器官。同年Sandro Nuciforo 等人成功從晚期肝癌患者穿刺樣本中培養出肝癌類器官,并在連續培養32周后成功鑒定[4]。研究結果發現肝癌類器官仍保持原發腫瘤的基因組特征和遺傳異質性。
2019 年,Takebe 等人在國際上首次利用iPSC成功構建了肝臟、胰腺和膽管三個相互連接的類器官,為研究人體器官早期形成復雜的相互作用過程提供了可能[5]。 2019 年,Sun等人使用具有滅活 p53 和 Rb 的重組人干細胞培養具有肝臟結構和功能的類器官[6]。并且通過基因工程技術觀察到c-Myc的過度表達會導致肝臟類器官的致癌作用。通過分析人類肝內膽管癌細胞中的富集突變,他們證明聯合抑制 Notch 和 JAK-STAT 可防止 RAS 誘導的肝細胞向肝內膽管癌細胞的轉變。
2020年,關等人通過肝臟類器官建模,確定了一種對早期肝臟發育至關重要的途徑,即磷脂酰乙醇胺生物合成 [7]。基于這一發現,他們研發了一種治療原發性肝癌的新型聯合藥物。
4、腸道疾病研究靶點
參考文獻:
[1] Meritxell Huch, Craig Dorrell, Hans Clevers, et al. In vitro expansion of single Lgr5+ liver stem cells induced by Wnt-driven regeneration [J]. Nature. 2013 Feb 14; 494(7436): 247–250.
[2] Ma Xuanyi, Qu Xin, Zhu Wei, et al. Deterministically patterned biomimetic human iPSC-derived hepatic model via rapid 3D bioprinting [J]. Proc Natl Acad Sci, 2016, 113: 2206-2211.
[3] Broutier L, Mastrogiovanni G, Verstegen MM, et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening [J]. Nature Medicine, 2017, 23(12): 1424-1435.
[4] Sandro, N., et al. Organoid Models of Human Liver Cancers Derived from Tumor Needle Biopsies [J]. Cell Reports, 2018. 24(5): p. 1363-1376.
[5] Koike H, Iwasawa K, Ouchi R, et al. Modelling human hepatobiliary-pancreatic organogenesis from the foregut-midgut boundary [J]. Nature, 2019, 574(7776) : 112-116.
[6] Sun, L., et al. Modelling liver cancer initiation with organoids derived from directly reprogrammed human hepatocytes [J]. Nature Cell Biology, 2019. 21(8): p. 1015-1026.
[7] Guan Yuan, Chen Xinyu, Wu Manhong, et al. The phosphatidylethanolamine biosynthesis pathway provides a new target for cancer chemotherapy [J]. Hepatology, 2020, 72(4): 746-760.






