腦類器官
源自人類多能干細胞(hPSC)的人類腦類器官,概括了早期人類大腦神經發育的特征,包括神經祖細胞的生成、增殖和分化為神經元,膠質細胞,以及發育中的大腦不同類型新生細胞之間的復雜相互作用。腦類器官主要由神經譜系細胞組成,如神經干細胞、神經元、星形膠質細胞和少突膠質細胞。
1、人類腦類器官的研究現狀及進展
人類的神經發育主要發生在胚胎期、胎兒期和新生兒階段,并分化成人類神經系統的各種神經細胞類型。由于大腦的復雜性,人類胚胎和胎兒組織的缺乏,以及相關的倫理問題,使得研究人類神經發育疾病工作極具挑戰。為了更深入地了解人腦的發育和病變,我們需要建立人腦的實驗模型。但這一問題直到2013年Lancaster等人建立了第一個模擬人腦3D結構的人腦類器官,才取得重大突破[1]。腦類器官培養技術的出現,為突破活體腦初始階段的實驗提供了一條非常光明的道路。
科學家們已經成功培育出腦類器官,但未能成功研發出類似于人腦的神經網絡。Cleber A,Trujillo 等人設計出一種更好的方法來培養人類干細胞,以誘導大腦外層神經元的形成[3]。他們發現,隨著發育的進展,從人類干細胞生長的腦類器官產生的腦電波變得更加復雜,并在微型大腦中形成了功能性神經回路 。這些腦電波在人類嬰兒的大腦發育過程中具有某些共同特征。該團隊旨在進一步改進類器官,并使用它們來了解與神經網絡相關的疾病,例如自閉癥、癲癇和精神分裂癥。In-Hyun Park 和他的同事找到了一種方法來突破人腦類器官中缺少血管網絡的問題。他們通過將轉錄因子 ETV2 在人類皮質類器官 (hCO) 中的異位表達,成功地在腦類器官中形成了復雜的功能性血管網絡 [4]。他們還表明,血管化的 hCOs (VhCOs) 分化為更復雜的結構,并且神經元更成熟。也是首次發現了與這些VhCOs結構相似的血腦屏障(blood-brain barrier,BBB)。
盡管人腦類器官確實在體外部分產生了人腦結構,但每一種都是獨一無二的,并且它們受到類器官間高變異性的困擾 [5,6]。這意味著它們不能輕易用于比較患病和正常腦組織之間的差異。這也引發了人們對人類大腦的發育過程是否可以在胚胎發生的背景下以與內源性組織相當的可重復性程度發生的懷疑。Silvia Velasco等人使用干細胞的特定組合,以相同的發育順序和組織結構連續生長多個人腦類器官[7]。這些培養出來的類器官具有相同的細胞組成和基本連接,能夠在體外培養環境中長期存活,并分化成構成大腦皮層的多種細胞類型,使得研究人員可以將這些類器官用于比較實驗研究和藥物篩選。
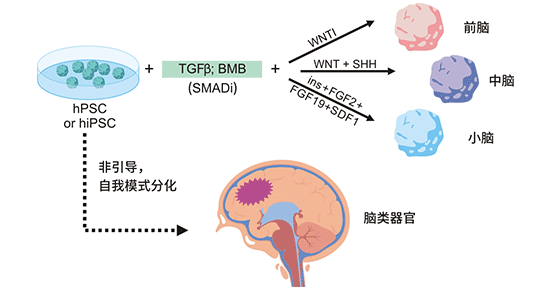
圖1. 人類腦類器官
圖片來源:https://www.frontiersin.org/articles/10.3389/fcell.2020.590119/full
2、腦類器官的應用
人類腦類器官可用于研究大腦發育過程和神經系統疾病以及神經再生功能。
SARS-CoV-2 主要攻擊呼吸系統,但一些感染者會出現一些與神經系統相關的癥狀,包括頭痛、嗅覺喪失、嗅覺障礙、意識模糊、癲癇和腦病。然而,沒有直接的實驗證據表明 SARS-CoV-2 會感染人類中樞神經系統 (CNS)。為了在生理相關模型中探索 SARS-CoV-2 在中樞神經系統中的直接參與關系,張寶中和他的團隊評估了 SARS-CoV-2 感染人類神經祖細胞 (hNPCs)、神經球和誘導多能干細胞中 (iPSC) 衍生的腦類器官 [8]。結果表明,iPSC 誘導的 hNPCs 對 SARS-CoV-2 感染呈現開放狀態。在感染 SARS-CoV-2 的神經球和腦類器官中檢測到廣泛的蛋白質表達和傳染性病毒顆粒,表明 SARS-CoV-2 可以有效地感染人腦。這項研究提供了人類大腦類器官中直接感染 SARS-CoV-2 的第一個證據,這可以幫助專家了解 COVID-19 神經系統并發癥的發病機制。
Jay Gopalakrishnan 的團隊通過修改將 iPSC 轉化為神經組織的培養條件,成功地在大腦類器官中誘導出雙邊對稱的視杯,并發現這種結構可以感知光,同時向其他區域的大腦發送信號 [9]。當這些類器官生長50-60天后,原來的“眼睛”發育成一兩個成熟的可見視泡結構,稱為視泡腦類器官(OVB-organoids)。這些 OVB 類器官目前只能存活 60 天。這項研究首先在功能上將視網膜結構整合到大腦類器官中,在體外系統中再現神經纖維從視網膜神經節向外延伸以連接大腦的目標區域。該系統可以幫助研究胚胎發育過程中的“腦-眼”相互作用,為視網膜疾病的探索和治療提供有力的工具,為無數視網膜疾病患者的治愈帶來希望。
人腦類器官是大腦的原始形式,但它不是真正的大腦,它只是為研究而制作的簡化模型。到目前為止,還沒有在實驗室中發現人腦類器官具有意識,大腦類器官不能重述行為或指示特定行為模式涉及哪些細胞類型。類器官只能彌補動物模型而不是替代它們。類器官可以做的是讓研究人員能夠更具體地進行動物實驗,或者更快速地從動物實驗中獲得結果,并以更有針對性的方式快速傳遞給患者。通過類腦器官的研究,我們對遺傳學有了更深入的了解,腦類器官研究每向前邁進一步,就有可能在更多疾病領域取得突破,將生理和病理關聯轉化為因果關系。
3、腦類疾病研究相關靶點
參考文獻:
[1] Lancaster MA, Renner M, Martin CA, et al. Cerebral organoids model human brain development and microcephaly [J]. Nature. 2013;501(7467):373-379.
[2] Qian Yang, Yan Hong, et al. What Makes Organoids Good Models of Human Neurogenesis [J]? Front. Neurosci., 14 April 2022.
[3] Cleber A. Trujillo, Richard Gao, et al. Complex Oscillatory Waves Emerging from Cortical Organoids Model Early Human Brain Network Development [J]. Cell Stem Cell. 2019 Oct 3; 25(4): 558–569.e7.
[4] Cakir, B., Xiang, Y., Tanaka, Y. et al. Engineering of human brain organoids with a functional vascular-like system [J]. Nat Methods 16, 1169–1175 (2019).
[5] Quadrato, G., Brown, J. & Arlotta, P. The promises and challenges of human brain organoids as models of neuropsychiatric disease [J]. Nat. Med. 22, 1220–1228 (2016).
[6] Quadrato, G. et al. Cell diversity and network dynamics in photosensitive human brain organoids. Nature 545, 48–53 (2017).
[7] Velasco, S., Kedaigle, A.J., Simmons, S.K. et al. Individual brain organoids reproducibly form cell diversity of the human cerebral cortex [J]. Nature 570, 523–527 (2019).
[8] Bao-Zhong Zhang, Hin Chu, et al. SARS-CoV-2 infects human neural progenitor cells and brain organoids [J]. Cell Res. 2020 Oct; 30(10): 928–931.
[9] Elke Gabriel, Walid Albanna, Jay Gopalakrishnan, et al. Human brain organoids assemble functionally integrated bilateral optic vesicles [J]. Cell Stem Cell 28 (10): 1740-1757.e8, 2021.






