腸類器官
2007年Clevers研究組在小鼠模型中證明Lgr5+上皮細胞是真正的腸上皮干細胞后[1],腸干細胞領域的研究在接下來的幾年中取得了很大的進展。該領域最具影響力的突破之一是建立了腸道干細胞體外3D培養系統。 Clevers 和他的同事于 2009 年在 Matrigel 中進行了 3D 培養,從成人腸道干細胞中生成了腸道類器官 [2]。這是對腸道類器官培養首次使用小鼠小腸段進行描述。
3D 腸道類器官由一個封閉的循環空腔組成,空腔內襯一層腸上皮細胞系。腸上皮的分化細胞譜系,包括腸上皮細胞、腸內分泌細胞和杯狀 (Paneth) 細胞,排列在絨毛區。腸道類器官可以來源于器官限制性成體干細胞 (ASCs) 和多能干細胞 (PSCs)。這兩種干細胞產生的類器官包含體內發現的所有腸上皮細胞類型,比例和排列相似。它們可以更大程度地模擬腸道組織,因此被稱為“迷你腸道”。大腸腫瘤細胞也可以用這個 3D 系統培養,以獲得腫瘤樣器官。總的來說,腸道類器官是研究腸道營養運輸、藥物吸收、胃腸癌和腸道胰高血糖素激素分泌的寶貴模型。
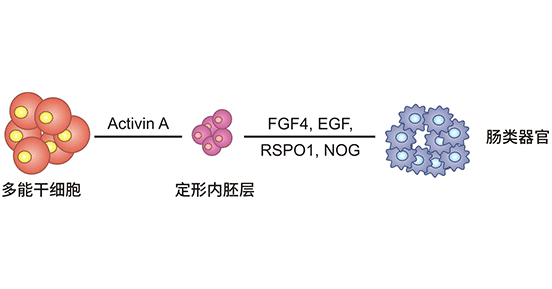
圖1. 腸類器官建立過程
腸道類器官現在被廣泛用于人類疾病研究。與以往的腸道疾病模型包括細胞系培養或體內動物實驗相比,類器官培養具有培養成功率高、培養周期短、組織差異小、易于建立低惡性腫瘤模型等明顯優勢。與傳統的實驗模型(二維細胞系培養和動物模型)相比,腸道類器官具有諸多優勢。體外構建的腸類器官模型包含所有類型的腸上皮細胞,具有單細胞系無法比擬的水、鐵吸收和運輸等生理功能。此外,動物模型與人體模型存在較大的物種差異,無法完全模擬人體腸道的真實生理反應,而來源于人體組織的腸道類器官可以更準確地反映人體的生理和病理變化。
1、腸道類器官的最新研究
Yui等人在2012年報道小鼠實驗證實體外培養的腸類器官可以通過肛門灌腸修復DSS(Dextransulfatesodium)誘導的結腸炎,并且這些培養出來的腸道類器官可以準確到達受傷的上皮部位,修復受損的腸上皮組織[3] 。
Laween Meran等人使用完整的納米結構脫細胞人腸基質作為生物支架[4]。蛋白質組學和拉曼光譜分析揭示了人類小腸和結腸支架的高度相似的生化特征,表明它們可以互換用作腸道工程的平臺。然后,研究人員將體外擴張的空腸類器官植入任何類型的支架上,以有效重建具有消化和吸收等生理功能的中空移植物。移植物被移植到小鼠腎囊或皮下,可以存活并形成管腔結構。該研究為在腸衰竭兒童患者使用特異性空腸移植療法提供了概念驗證數據,并推進了治療腸衰竭兒童的臨床試驗過程。
2020年7月3日,類器官研究先驅 Hans Clevers 及其團隊在《Science》雜志上發表了題為《SARS-CoV-2 productively infects human gut enterocytes》的文章,發現在小腸類器官中,SARS-CoV-2 很容易感染腸道細胞。上皮細胞,受感染腸上皮細胞的病毒應答基因顯著上調[5]。這項研究提供了腸道上皮細胞支持 SARS-CoV-2 復制的證據,表明人類腸道類器官可以作為病毒感染和生物學研究的實驗模型。
Ana C Silva 等人使用多種 iPSC 衍生的類器官,概括了體內心臟和腸道的協調發育和成熟,證明類器官中內胚層組織(腸道/腸)的存在有助于心臟組織的發育和成熟 [6]。這項研究表明,來自許多種系的合作組織可以在單個類器官模型中產生和成熟,這一突破將有助于研究發育、生理成熟和疾病過程中的多組織相互作用。
Satoshi Watanabe等人使用柔性導管將大約 1,000 個類器官注入結腸,其中上皮損傷最嚴重 [7]。培養的類器官的上皮細胞附著在受損表面并與宿主的上皮組織(結腸內的細胞層)結合,最終形成完整的上皮組織,其中部分受損上皮層已被類器官上皮細胞取代,這項研究為使用結腸類器官移植治療嚴重潰瘍性結腸炎的人體臨床試驗奠定了基礎。今天,本研究中開發的方案已轉化為臨床實踐,科學界和臨床界都對未來的臨床應用感到興奮。
2、結腸類器官培養細胞因子
- EGF
- Noggin
- R-spondin 1
- Wnt-3a
3、腸道疾病研究靶點
參考文獻:
[1] Barker N, van Es J H, Kuipers J, et al. Identification of stem cells in small intestine and colon by marker gene Lgr5. Nature, 2007, 449: 1003–1007.
[2] Sato, T., Vries, R. G., et al. (2009). Single Lgr5 stem cells build crypt-villus structures in vitro without a mesenchymal niche [J]. Nature 459, 262–265.
[3] Yui S, Nakamura T, Sato T, et al. Functional engraftment of colon epithelium expanded in vitro from a single adult Lgr5+ stem cell. Nat Med, 2012, 18: 618–623.
[4] Laween Meran, Isobel Massie,et al. Engineering transplantable jejunal mucosal grafts using patient-derived organoids from children with intestinal failure [J]. Nature Medicine volume 26, pages1593–1601 (2020).
[5] Mart M. Lamers, Joep Beumer, et al. SARS-CoV-2 productively infects human gut enterocytes [J]. Science. 2020 May 1 : eabc1669.
[6] Ana C Silva, Oriane B Matthys, et al. Co-emergence of cardiac and gut tissues promotes cardiomyocyte maturation within human iPSC-derived organoids [J]. Cell Stem Cell. 2021 Dec 2;28(12):2137-2152.e6.
[7] Satoshi Watanabe, Sakurako Kobayashi, et al. Transplantation of intestinal organoids into a mouse model of colitis [J]. Nat Protoc. 2022 Mar;17(3):649-671.






