
CAR-T療法是一種將患者自身的T細胞通過基因工程改造,使其表達特異性的嵌合抗原受體(CAR),從而增強其對癌細胞的識別和攻擊能力的免疫療法。該療法在一些惡性腫瘤,特別是在某些難治性血液癌癥的中展現出了驚人的療效。
CAR生“萬物”:從CAR-T到CAR-X
隨著對免疫系統的深入了解,CAR技術的應用范圍正不斷拓寬,新型CAR細胞療法的開發逐漸成為熱點,如CAR-NK、CAR-M、CAR-Treg和CAR-γδ等。相比CAR-T療法潛在的不良反應和無法應用于實體瘤治療的痛點,這些新型CAR細胞療法存在各自的優勢,為免疫療法的蓬勃發展注入了新的活力。
CAR的基本結構
無論是CAR-T,還是CAR-NK、CAR-M,它們都具有相似的CAR結構。CAR結構主要包括三個部分:胞外結構域、跨膜結構域和胞內結構域。
胞外結構域通常是一個單鏈可變片段(scFv),該片段由一個linker將抗體的可變重鏈(VH)和可變輕鏈( VL)連接形成,用于識別腫瘤抗原;一段鉸鏈區將scFv與跨膜域相連,提供克服空間位阻的靈活性,以允許scFv進入靶向表位;跨膜結構域的主要功能是確保CAR穩定嵌入細胞膜;胞內結構域則包括共刺激結構域和信號轉導結構域,用于激活和增強免疫細胞的反應。
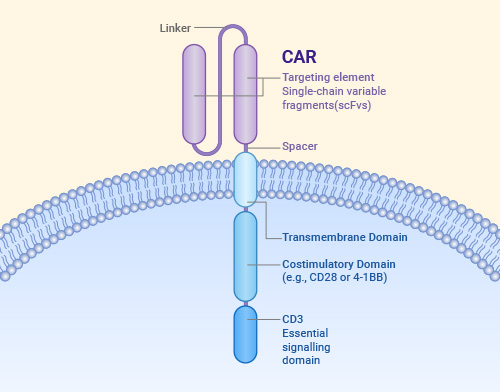
Structural elements of a chimeric antigen receptor(CAR)
Rodríguez-Lobato LG, et al. Front Oncol. 2020.
為什么進行CAR檢測?
目前,隨著越來越多的基于CAR技術的細胞療法進入臨床研究階段,CAR表達部分的檢測作為藥物質控的關鍵環節,將直接影響治療效果,相關法規更是對CAR陽性率的檢測提出了明確要求。因此,為了確保從早研階段的CAR細胞制備和功能測試、CMC階段的細胞質量和純度評估、臨床測試階段的細胞體內監測和PK研究等各個環節都能嚴格把控,開發準確、簡便、通用的CAR陽性率檢測試劑顯得尤為重要。
現有的CAR的檢測方法比較
常見的CAR檢測方法包括針對人/小鼠IgG F(ab')2片段的多克隆抗體、抗獨特型抗體、Protein L等,雖然各有優勢,但也存在一些局限性,如需要針對每個CAR設計特異性抗體,成本較高,只能用于檢測已知抗原等*。
| 檢測方法 | 檢測機制 | 優勢 | 劣勢 |
|---|---|---|---|
| Anti-human F(ab')2 pAb 和Anti-mouse F(ab')2 pAb | 結合IgG F(ab')2 片段 |
|
|
| Anti-idiotypic antibodies | 特異性結合scFv 抗原識別區 |
|
|
| rh-protein | 特異性結合scFv 抗原識別區 |
|
|
| Protein L | 結合抗體K輕鏈 |
|
|
| 本司產品 Linker-specific mAbs |
檢測CAR連接子 |
|
|
*Linker-specific monoclonal antibodies present a simple and reliable detection method for scFv-based CAR NK cells. Mol Ther Methods Clin Dev. 2024.
華美生物的linker-specific mAb產品
由于目前大多數CAR的構建體都含有Whitlow或G4S linker的單鏈可變片段(scFv),Whitlow (GSTSGSGKPGSGEGSTKG)linker主要用于針對血液惡性腫瘤的CAR構建,如CD19 CAR [1],而G4S(glycine4-serine)linker 則常用于針對實體瘤抗原的CAR,如HER2和CEA [2],若針對這兩種linker開發特異性單克隆抗體則可以檢測廣泛的CAR。基于此技術背景,華美生物現全新推出一組高效、通用性強的CAR陽性率檢測工具--抗Whitlow Linker抗體和抗G4S Linker抗體。
● 產品列表
| 產品名稱 | 產品貨號 | 克隆號 |
|---|---|---|
| Whitlow linker Monoclonal Antibody | CSB-MA234468A0m | 18A3G5 |
| G4S linker Monoclonal Antibody | CSB-MA186062I1m | 11A12E7 |
| G4S linker Monoclonal Antibody | CSB-MA186062I2m | 12F11C10 |
| G4S linker Monoclonal Antibody | CSB-MA186062I3m | 14A10E7 |
● 產品優勢
- 針對連接子特異性結合:特異性識別連接子序列,避免了與CAR其他區域的非特異性結合。
- 避免假陽性:由于linker-specific mAbs不與血清中的IgG或其他蛋白質結合,因此不會產生假陽性結果。
- 適用于大多數CAR: 大多數CAR都包含Whitlow或G4S 連接子,具有很強的通用性。
- 不受抗原特異性限制:不針對特定的抗原結合區域,可以檢測不同抗原的CAR。
- 直接用于流式細胞術:無需復雜的實驗步驟,操作簡便,易于標準化。
- 兼容其他方法: 可以與其他檢測方法(如rh-proteins)結合使用,提高檢測的特異性和敏感性。
● 產品數據
(貨號: CSB-MA234468A0m)
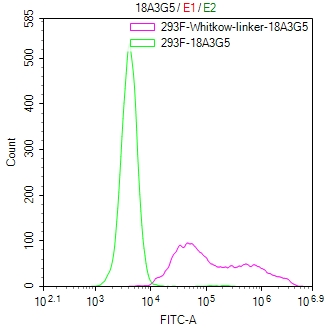
Untransfected HEK-293F cells (green line) and transfected scFv-based Anti-CD19 CAR containing a Whitlow/218 linker stable cells (red line) were stained with anti-Whitlow linker antibody (2μg/1*106), washed and then followed by FITC-conjugated anti-Mouse IgG Fc antibody and analyzed with flow cytometry.
(貨號: CSB-MA234468A0m)
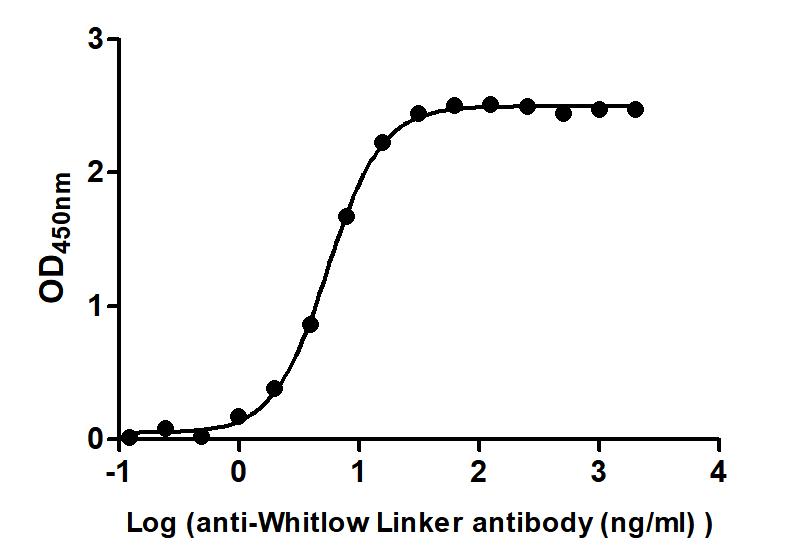
Immobilized scFv-based Anti-CD19 CAR recombinant antibody at 2 μg/mL can bind Anti-Whitlow linker antibody. The EC50 is 5.147 to 5.761 ng/mL.
(貨號: CSB-MA186062I1m)
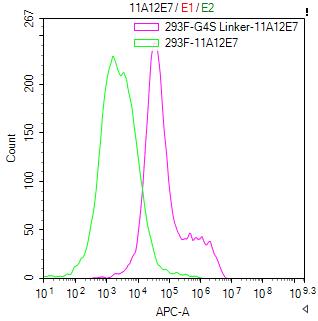
Untransfected HEK-293F cells (green line) and transfected scFv-based Anti-CD19 CAR containing a G4S linker stable cells (red line) were stained with anti-G4S linker antibody (2μg/1*106), washed and then followed by APC-conjugated anti-Mouse IgG Fc antibody and analyzed with flow cytometry.
(貨號: CSB-MA186062I2m)
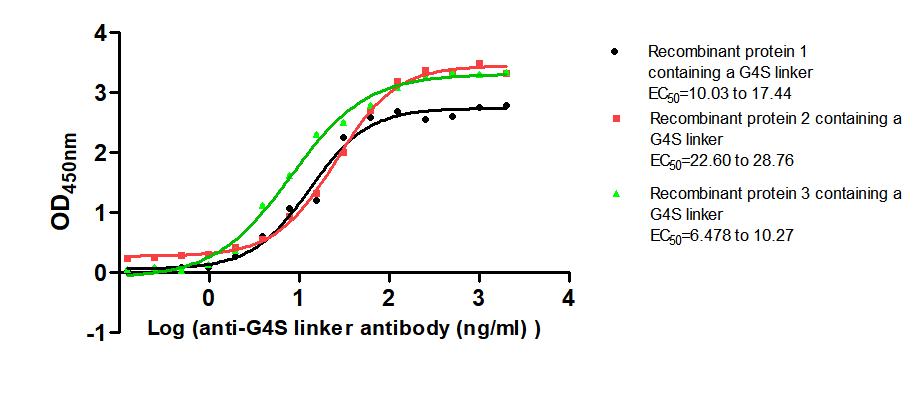
Immobilized Three recombinant proteins containing G4S linker at 2 μg/mL can bind Anti-G4S linker antibody. The EC50 is 10.03 to 17.44 ng/mL, 22.60 to 28.76 ng/mL and 6.478 to 10.27 ng/mL.
相關資源:
參考文獻:
[1] B-cell depletion and remissions of malignancy along with cytokine-associated toxicity in a clinical trial of anti-CD19 chimeric-antigen-receptor-transduced T cells. Blood. 2012.
[2] CAR-T cell potency: from structural elements to vector backbone components. Biomark Res. 2022.










