呼吸道合胞病毒(RSV)
呼吸道合胞病毒(Respiratory Syncytial Virus, RSV)是一種非節段性的單股負鏈RNA病毒,屬于副粘病毒科(Paramyxoviridae),肺炎病毒屬,因其能將感染的細胞融合而得名。RSV可在全球范圍內引起嬰幼兒、老年人和免疫功能低下者呼吸道感染,是5歲以下兒童下呼吸道感染的主要致病原因,每年導致約3300萬例下呼吸道感染病例,其中中國約占十分之一,即350萬例。據估計,我國每年因RSV感染住院的嬰幼兒人數在30萬到50萬之間。
1. RSV病毒的結構
RSV的病毒顆粒形態多樣,包括球形、不對稱形和絲狀形,直徑約為130納米,長度可以從幾百納米到超過10微米不等。
RSV的結構組成主要包括病毒包膜和內部的核糖核蛋白復合體(RNP)。病毒包膜由融合蛋白(F)、附著蛋白(G)和小疏水蛋白(SH)等糖蛋白組成。這些糖蛋白在病毒的吸附、融合和感染過程中起著重要作用。其中,G蛋白是病毒的主要附著蛋白,負責與宿主細胞受體結合;F蛋白則介導病毒囊膜與宿主膜的融合。RSV的核糖核蛋白復合體由RNA和核衣殼蛋白(N蛋白)組成,這些復合體在病毒顆粒內部形成螺旋狀結構,保護并復制病毒的RNA [1]。
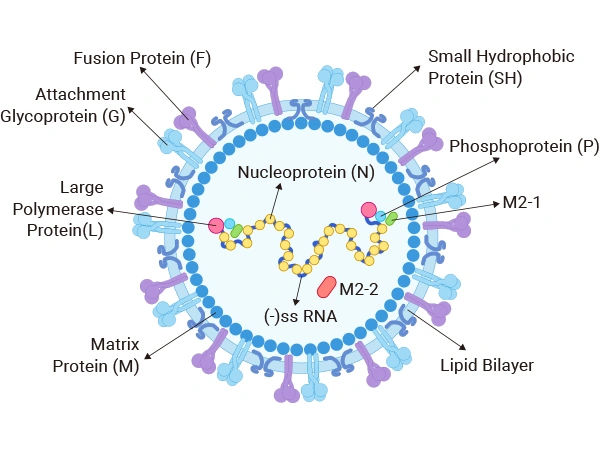
圖1. 呼吸道合胞病毒結構
RSV病毒的基因組由具有10個開放閱讀框(ORF)的單鏈負義RNA組成,總長度約為15.2kb。它編碼11種結構和非結構蛋白,這些蛋白在病毒的復制、裝配和感染過程中發揮著各自的作用。具體列舉如下:
| 蛋白名稱 | 功能描述 |
|---|---|
| 融合蛋白(F) | 介導病毒與宿主細胞膜的融合,使病毒進入細胞內。是產生中和抗體的重要抗原位點,也是誘導機體產生免疫原性和抗病毒的主要靶點。 |
| 黏附蛋白(G) | 負責將病毒吸附到宿主細胞表面,啟動感染過程。G蛋白高度變異,與抗原表位決定簇和病毒基因多樣性的關系密切,在區分RSV A、B亞型方面起重要作用。 |
| 小疏水蛋白(SH) | 一種跨膜蛋白,具體功能可能涉及病毒的感染和復制過程,但相對于F和G蛋白,其重要性較低。 |
| 核蛋白(N) | 與病毒的RNA結合,形成核衣殼,保護病毒的遺傳物質。 |
| 磷酸蛋白(P) | 與N蛋白和L蛋白一起構成病毒的復制復合物,參與病毒的復制過程。 |
| RNA聚合酶蛋白(L) | 具有RNA聚合酶活性,負責病毒的RNA合成和復制。 |
| 基質蛋白M1(M) | 位于脂質包膜下方,與復制復合物結合,參與病毒的裝配過程。 |
| 基質蛋白M2(M2-1) | 與M蛋白一起參與病毒的裝配和出芽過程,同時可能具有調節病毒RNA合成的作用。 |
| 基質蛋白M2-2(M2-2) | 參與病毒的復制和轉錄過程,可能通過調節病毒RNA的合成來影響病毒的復制效率。 |
| 非結構蛋白NS1 | 具體功能尚不完全清楚,但可能參與調節病毒的復制和感染過程。 |
| 非結構蛋白NS2 | 同樣具有調節病毒復制和感染過程的功能,但具體機制尚待研究。 |
2. RSV病毒的感染機制
RSV的感染機制涉及多個步驟,如病毒的附著、進入、復制、組裝和釋放:
向內是由8片單鏈RNA組成的病毒基因組(僅甲型和乙型)。RNA被核蛋白和異三聚體RNA依賴的RNA聚合酶(三個亞單位:PB1、PB2和PA)包裹,組裝成螺旋狀的核糖核蛋白(RNP)復合物。核外蛋白(NEP)也存在于病毒內部。
- 病毒附著:通過飛沫傳播,首先附著在宿主的上呼吸道上皮細胞表面。病毒表面的G蛋白(糖蛋白)識別并結合到宿主細胞表面的特定受體。這些受體包括硫酸肝素蛋白多糖(HSPGs)和其他可能的受體分子。
- 病毒進入:附著完成后,病毒表面的F蛋白(融合蛋白)發生構象變化,介導病毒囊膜與宿主細胞膜的融合后,病毒的核衣殼進入宿主細胞。除了膜融合,RSV還可以通過內吞作用進入細胞。病毒被宿主細胞的胞吞作用攝入,形成內吞體。在內吞體內,酸性環境促使F蛋白進一步激活,最終導致病毒囊膜與內吞體膜融合,釋放病毒核衣殼到細胞質中。
- 病毒復制:病毒核衣殼進入宿主細胞后,RSV的核衣殼解體,釋放出單股負鏈RNA基因組。病毒RNA基因組被病毒RNA依賴的RNA聚合酶(由L蛋白和P蛋白組成)識別并轉錄成正鏈mRNA。這些mRNA隨后被翻譯成病毒蛋白,包括結構蛋白和非結構蛋白。病毒RNA聚合酶還負責合成新的負鏈RNA基因組,這些基因組將被包裝進新的病毒顆粒中。
- 病毒組裝與釋放:新合成的病毒RNA與N蛋白結合,形成新的核衣殼。新的核衣殼移動到宿主細胞的細胞膜附近,與M蛋白相互作用,招募囊膜上的G蛋白和F蛋白,形成新的病毒顆粒。成熟的病毒顆粒通過宿主細胞膜的出芽過程被釋放到細胞外環境中。這個過程中,病毒顆粒獲得了宿主細胞膜的一部分作為自己的囊膜。
- 免疫反應與病理:感染觸發宿主的先天免疫和適應性免疫反應。先天免疫反應包括產生干擾素和其他炎癥介質,而適應性免疫反應則涉及產生特異性抗體和T細胞應答。RSV感染導致氣道上皮細胞損傷,炎癥細胞浸潤,氣道分泌物增多,氣道狹窄和高反應性。這些病理變化可以引起咳嗽、喘息、呼吸困難等癥狀,嚴重時可能導致支氣管炎和肺炎。
了解RSV病毒的感染機制對于開發有效的預防和治療策略至關重要。目前,針對RSV感染的疫苗和抗病毒藥物的研發正在取得進展,旨在通過干預這些關鍵步驟來減輕RSV的傳播和致病性。
3. RSV抗病毒藥物研究主要靶點及相關藥物研究進展
RSV抗病毒藥物研究的相關靶點主要包括F蛋白、RNA聚合酶、核苷類似物、宿主因子以及脫氧鳥嘌呤核苷酸合成途徑等。這些靶點的研究為開發新型抗RSV藥物提供了重要的基礎。
- 融合蛋白(F蛋白):蛋白是RSV進入宿主細胞的關鍵因素,通過介導病毒包膜與宿主細胞膜的融合來完成病毒的進入過程。因此,針對F蛋白的抑制劑是研究的重點之一。例如,GS-5806和BMS-433771都是通過抑制F蛋白介導的膜融合來阻止病毒進入宿主細胞 [2]。此外,RV521也是一種針對RSV-F蛋白的小分子抑制劑,已在臨床試驗中顯示出減少病毒載量和改善疾病嚴重程度的效果 [3]。
- 核苷酸依賴性RNA聚合酶(RdRp):RSV的RNA聚合酶是另一個重要的藥物靶點。通過抑制病毒的RNA復制過程,可以有效阻斷病毒的生命周期。例如,結構基礎設計策略發現了針對RSV RdRp的新異構體結合位點,開發出了一些具有抗病毒活性的小分子抑制劑 [4]。
- 宿主因子:近年來,越來越多的研究開始關注針對宿主因子的抗病毒藥物開發。例如,核糖核蛋白(N蛋白)和G蛋白也是重要的靶點,因為它們在病毒感染過程中起著關鍵作用 [5]。此外,核仁蛋白(nucleolin)也被發現是RSV的重要受體,針對其RNA結合域的藥物可以有效抑制RSV感染 [6]。
- 脫氧鳥嘌呤核苷酸合成途徑:一些研究表明,通過抑制宿主細胞中的脫氧鳥嘌呤核苷酸合成途徑,也可以有效抑制RSV的復制。例如,probenecid這種FDA批準的藥物通過抑制有機陰離子轉運蛋白(OATs),顯示出對RSV復制的抑制作用 [7]。
4. RSV研究相關重組蛋白
| Target | Product Name | Source | Tag Info | Product Code |
|---|---|---|---|---|
| N | Recombinant Bovine respiratory syncytial virus Nucleoprotein (N) | E.coli | N-terminal 6xHis-SUMO-tagged | CSB-EP339612BKT |
| F | Recombinant Human respiratory syncytial virus A Fusion glycoprotein F0 (F), partial | E.coli | N-terminal 6xHis-B2M-tagged | CSB-EP356041HPO |
| F | Recombinant Human respiratory syncytial virus A Fusion glycoprotein F0 (F), partial | E.coli | N-terminal 6xHis-tagged | CSB-EP356041HPOa0 |
| F | Recombinant Human respiRatory syncytial virus A Fusion glycoprotein F0 (F), partial | Yeast | N-terminal 6xHis-tagged | CSB-YP356041HPO |
| G | Recombinant Human respiratory syncytial virus A Major surface glycoprotein G (G), partial | Baculovirus | N-terminal 10xHis-tagged and C-terminal Myc-tagged | CSB-BP365937HPO |
| G | Recombinant Human respiratory syncytial virus A Major surface glycoprotein G (G), partial | E.coli | N-terminal 6xHis-SUMO-tagged | CSB-EP365937HPO |
| G | Recombinant Human respiratory syncytial virus A Major surface glycoprotein G (G), partial, Biotinylated | E.coli | N-terminal 6xHis-SUMO3-Avi-tagged | CSB-EP365937HPOm4-B |
| F | Recombinant Human respiratory syncytial virus A Fusion glycoprotein F0 (F), partial | E.coli | N-terminal 10xHis-tagged and C-terminal Myc-tagged | CSB-EP319265HPWb1 |
| G | Recombinant Human respiratory syncytial virus B Major surface glycoprotein G (G), partial | E.coli | N-terminal 6xHis-tagged | CSB-EP323293HPX |
| N | Recombinant Human respiratory syncytial virus B Nucleoprotein (N) | E.coli | N-terminal 10xHis-tagged and C-terminal Myc-tagged | CSB-EP340633HPX |
| F | Recombinant Human respiRatory syncytial virus B Fusion glycoprotein F0 (F), partial | Yeast | N-terminal 6xHis-tagged | CSB-YP516611HXK |
| M2-1 | Recombinant Human respiratory syncytial virus B Matrix M2-1 (M2-1) | E.coli | N-terminal 6xHis-tagged and C-terminal 6xHis-tagged | CSB-EP518618HXK |
參考文獻:
[1] Crystal structure of a nucleocapsid-like nucleoprotein-RNA complex of respiratory syncytial virus. Science, 2009.
[2] Oral GS-5806 Activity in a Respiratory Syncytial Virus Challenge Study. The New England Journal of Medicine, 2014.
[3] A Randomized, Placebo-Controlled, Respiratory Syncytial Virus Human Challenge Study of the Antiviral Efficacy, Safety, and Pharmacokinetics of RV521, an Inhibitor of the RSV-F Protein. Antimicrobial Agents and Chemotherapy, 2020.
[4] Structure-Based Discovery of Allosteric Inhibitors Targeting a New Druggable Site in the Respiratory Syncytial Virus Polymerase. ACS Omega, 2024.
[5] Progress in studies on drugs and their target points against respiratory syncytial virus. Chinese Journal of Clinical Hepatology, 2020.
[6] Identification of RSV Fusion Protein Interaction Domains on the Virus Receptor, Nucleolin. Viruses, 2021.
[7] Probenecid Inhibits Respiratory Syncytial Virus (RSV) Replication. Viruses, 2022.






