細胞因子風暴和病毒感染 你必須知道的
日期:2023-12-21 15:15:42
在2020年1月25日,曹彬教授的團隊發表了一篇名為《中國武漢地區感染2019年新型冠狀病毒患者的臨床特點》的研究論文。該論文揭示了嚴重患有SARS-CoV-2(以前稱為:2019-nCoV)的患者免疫系統存在致命的細胞因子風暴。那么什么是細胞因子風暴?為什么病毒會引起細胞因子風暴,以及其機制是什么?是否有細胞因子風暴的治療方法?在本文中,我們將專注于病毒感染引起的細胞因子風暴。我們將從以下幾個方面為您解釋:
1. 什么是細胞因子風暴?
細胞因子風暴,也被稱為高細胞因子疾病,是一個健康而強大的免疫系統的全身性表達,導致釋放超過150種炎癥介質,如TNF-α、IL-1、IL-6、IL-12、IFN-α、IFN-β、IFN-γ、MCP-1和IL-8等。血清中既有促炎細胞因子,也有抗炎細胞因子的升高,這些細胞因子之間的激烈而常常致命的相互作用被稱為“細胞因子風暴”。
這是由細胞因子與免疫細胞之間的正反饋循環引起的嚴重過度免疫反應。癥狀包括高熱、紅腫、嚴重疲勞和惡心,有時可能導致致命后果。細胞因子風暴是急性呼吸窘迫綜合癥和多器官功能衰竭的重要原因(圖1)。
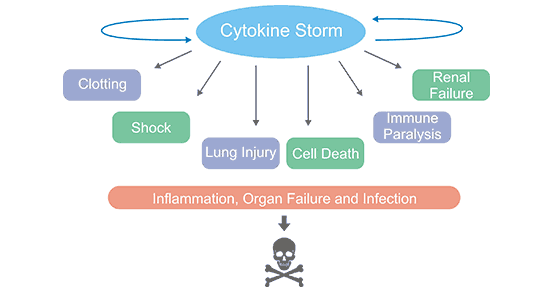
圖1. 細胞因子風暴導致直接器官損傷
2. 為什么病毒侵襲會引發細胞因子風暴?
病毒通過受體介導的內吞作用進入宿主目標細胞,大量增殖繁衍,然后通過出芽或誘導編程性細胞死亡釋放更多病毒。這些釋放的病毒被宿主免疫細胞上的模式識別受體所識別。隨后,免疫細胞通過一系列信號傳導釋放大量細胞因子,激活更多免疫細胞,參與病毒的清除。
然而,正如你所知,免疫是一把雙刃劍。當機體的免疫激活試圖清除異質性致病微生物時,也會導致機體自身的損傷。如果病毒數量龐大,免疫力強大,會導致更嚴重的局部抗爭,引發局部炎癥和細胞損傷,即細胞因子風暴。此時,病情可能會惡化。
以埃博拉病毒為例,它通過潛伏在宿主未成熟的樹突狀細胞、巨噬細胞等中,逃避免疫系統的識別。經過大量復制和迅速傳播,導致多器官細胞壞死和分解。當埃博拉病毒隨著分解的細胞一起釋放出來時,免疫系統會迅速識別。由于病毒數量龐大,免疫系統被充分激活,釋放大量促炎細胞因子、組織因子和血管活性肽。這些釋放的因子導致穿透血管壁,釋放大量一氧化氮,造成血管壁的繼發性損傷,破壞凝血系統。這些反應將引起體內發熱、內出血,最終導致多器官功能衰竭(圖2)。
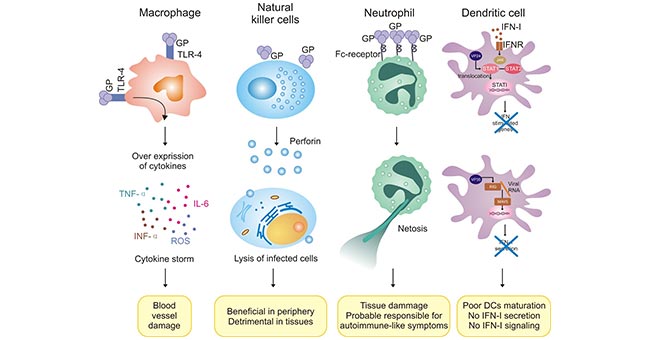
圖2. 先天免疫細胞在埃博拉病毒感染中的異常調控
3. 病毒與細胞因子風暴
細胞因子風暴在病毒感染、某些藥物以及造血系統疾病中較為常見。細胞因子風暴是急性呼吸窘迫綜合癥(ARDS)和多器官功能衰竭的重要原因之一。在許多疾病中,它也是死亡的重要原因之一,并且近年來引起越來越多的關注。在本文中,我們主要關注由病毒感染引發的細胞因子風暴。除埃博拉病毒外,登革熱病毒、高致病性禽流感病毒(H5N1、H1H1等)、巨細胞病毒、天花病毒、SARS病毒和MERS病毒均可引發細胞因子風暴。
3.1 SARS病毒與細胞因子風暴
嚴重急性呼吸綜合癥(SARS)是由SARS冠狀病毒感染引起的高熱、干咳和胸悶等主要癥狀。這起事件始于2002年12月。關于SARS引發的細胞因子風暴,香港大學的裴宇翔博士在尸檢中發現,嚴重SARS患者的肺組織受損嚴重,肺泡中存在多核巨細胞,肺泡巨噬細胞核內的兩性染色質結合蛋白染色陽性增多。這些細胞可以分泌TNF、IL-1、TGF等細胞因子,然后誘導成纖維細胞激活、細胞外基質沉積和肺泡上皮損傷修復。肺組織中紅細胞的吞噬現象表明,細胞因子調節失控。據推測,SARS感染引發了許多炎癥介質的釋放。
劉志英檢測到治愈和死亡SARS患者體內存在大量炎癥和抗炎因子。高水平的IL-6、IL-8和IL-10表明這三種細胞因子在疾病進展中發揮重要作用。在SARS患者的治療中,常常使用類固醇激素來抑制細胞因子的釋放,減少免疫反應并降低死亡率。
正如在《2019新型冠狀病毒》一文中所提到的,SARS-CoV-2與2002年的SARS-CoV序列相似度約為70%,與MERS-CoV相似度約為40%。SARS-CoV-2是一種新的冠狀病毒毒株,之前在人類中從未發現過。感染冠狀病毒的人通常表現出呼吸癥狀、發熱、咳嗽、呼吸急促和呼吸困難。在更嚴重的情況下,感染會引發肺炎、嚴重急性呼吸綜合癥、腎功能衰竭,甚至導致死亡。2019-nCoV感染引發了嚴重的肺炎疫情。感染者大多是健康人和年輕成年人,癥狀類似于SARS。部分患者會在病情從輕微轉為嚴重時出現突然變化,細胞因子風暴成為不可忽視的問題。
3.2 流感病毒與細胞因子風暴
流感病毒引發小鼠膠質細胞細胞因子風暴。周建祥等分離培養了新生小鼠腦皮層的膠質細胞,分別在6小時和24小時內體外感染星形膠質細胞和小膠質細胞的甲型H1N1和H3N2流感病毒。收集上清液并通過超濾分子保留去除流感病毒。分別用不同培養時間的條件上清液刺激星形膠質細胞和小膠質細胞。24小時后提取RNA并進行逆轉錄,用實時熒光定量PCR檢測前炎性因子(TNF-α、IL-1β和IL-6)和趨化因子(IP-10、MCP-1和MIP-1)。
該研究表明,不同培養時間的條件上清液可上調正常膠質細胞中的前炎性因子TNF-α、IL-1β、IL-6和趨化因子IP-10、MCP-1、MIP-1,上調程度不同產生細胞因子級聯效應。甲型H1N1和H3N2流感病毒感染的星形膠質細胞引發的細胞因子級聯效應可能與免疫病理性損害有關。
3.3 EBV與細胞因子風暴
EBV相關的淋巴細胞增殖性疾病與細胞因子風暴有關。EBV相關淋巴細胞增殖性疾病(CAEBV)被稱為EBV+LPD,于2008年9月8日至9日在美國國立衛生研究院舉行的EBV-LPD研討會上提名。EBV+LPD分為B細胞型(EBV+B-LPD)和T/NK細胞型(EBV+T/NK-LPD)。也稱為出血性綜合征(HPS)。木村等分析了39例T-CAEBV和NK-CAEBV患者的病毒學差異和細胞因子分泌情況。他們發現IL-1β、IL-10和IFN-γ在血清中高度表達,但NK細胞型感染患者的IL-13水平高于T細胞型,部分進展為HPS的患者血清表達IL-1β和IFN-γ。此外,19例CAEBV患者的外周血單個核細胞中的細胞因子轉錄如IL-1α、IL-1β、IL-10、IL-12p35、IL-13、IL-15、TNF-α和IFN-γ增加。
此外,石井等發現單核細胞可以通過細胞膜上的IL-15促進EBV相關NK/T細胞增殖并分泌LMP1,展示了IL-15在EBV-LPD疾病進展中的重要作用。SNK6細胞系高度表達IFN-γ、IL-9和IL-10。IL-10通過促進LMP1和CD25的分泌間接促進細胞增殖。不同類型的EBV-LPD表達不同的細胞因子。
4. 是否有細胞因子風暴的治療方法?
目前,細胞因子風暴的治療主要包括以下四項措施:
- 抗休克療法(癥狀治療,救命第一):輸液以確保血容量,應用血管活性藥物,必要時進行機械通氣,保護重要器官功能;
- 支持和癥狀治療(恢復體力):常規輸液,維持水、電解質和酸堿平衡,營養支持等;
- 抑制過度的免疫細胞活化和細胞因子產生(痊愈,尋求康復):在臨床上,常常使用激素治療(腎上腺皮質激素等)以適當的劑量和方法,以及非甾體抗炎藥和自由基清除劑(大量維生素C、維生素E等)。
- 抗體中和細胞因子風暴(精準治療):使用中和升高的細胞因子的單克隆抗體,以防止嚴重疾病和死亡。
5. 是否有細胞因子風暴的藥物?
根據細胞因子風暴的機制,藥物開發的思路源于以下原則:
- 減少活化的細胞因子,如IL-12、IFN-γ、TNF-α等;
- 增加抑制性細胞因子,如IL-10、TGF-β等;
- 減少白細胞進入炎癥組織,如1-磷酸鞘脂(S1P)。
研究人員從以上三個思路進行了大量研究工作,研究了各種皮質類固醇、PPAR激動劑、S1P1受體激動劑、COX抑制劑、抗TNF抗體、ACEI / ARB抑制劑和OX40抑制劑等對抗細胞因子風暴的藥物。在上述治療方法中,目前在動物實驗中效果最好的與肺炎相關的細胞因子風暴治療是1-磷酸鞘脂受體1激動劑(S1PR1)。
磷酸鞘脂-1-磷酸(S1p)是一種信號性的鞘脂,具有五個亞型的受體,在肺組織中主要在血管內皮細胞和淋巴細胞中表達。S1P1激動劑(CYM-5442和RP-002)已被報道通過減輕細胞因子和抑制先天免疫細胞的浸潤,保護小鼠免于嚴重流感感染引起的死亡。
在2009年H1N1大流行性流感的小鼠模型中,單獨的S1P1受體激動劑可將致命感染引起的死亡率降低80%以上。此外,與奧司他韋的聯合使用可以將小鼠的死亡率降低96%。這是迄今為止在治療病毒引發的細胞因子風暴時使用免疫調節策略取得的最好效果。
目前,諾維諾的Siponimod,一種鞘脂-1-受體調節劑藥物,已獲得多發性硬化癥的治療批準。因此,Siponimmod能否用于SARS-CoV-2病毒感染引起的嚴重肺炎?與瑞德西韋相比,獲批的西泮酮具有更好的安全性,并且與在危重病人中大量使用激素相比,靶向性的西泮酮副作用更小,它是否與洛匹那韋/利托那韋等抗病毒藥物一起使用會效果更好?讓我們期待未來的科研。
參考文獻:
[1] Huang C, Wang Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China [J]. Lancet, 2020 Jan 24.
[2] Parsi M, Dargan K. Hemophagocytic Lymphohistiocytosis Induced Cytokine Storm Secondary to Human Immunodeficiency Virus Associated Miliary Tuberculosis[J]. Cureus 2020 Jan 07;12(1).
[3] Benjamin G. Chousterman, et al. Cytokine storm and sepsis disease pathogenesis[J]. Seminars in Immunopathology. July 2017, Volume 39, Issue 5, pp 517–528.
[4] Huang KJ, Su IJ, et al. An interferon-gamma-related cytokine storm in SARS patients [J]. J. Med. Virol. 2005 Feb;75(2).
[5] Sun Y, Jin C, et al. Host cytokine storm is associated with disease severity of severe fever withthrombocytopenia syndrome[J]. INFECT DIS. 2012, 7 (206).
[6] IshiiH, Takahara M, et al. Monocytes enhance cell pro-liferation and LMP1 expression of nasalnatural killer/T-cell lympho-ma cells by cell contact-dependent interactionthrough membrane-bound IL-15 [J]. Int J Cancer. 2011, 130 (1): 48-58.










