研究火熱的“銅死亡”
2022年3月17日,美國哈佛大學(xué)和麻省理工學(xué)院布羅德研究所的TODD R. GOLUB團隊合作,在頂級學(xué)術(shù)期刊Science發(fā)表題為“Copper induces cell death by targeting lipoylated TCA cycle proteins”的研究性論文,作者發(fā)現(xiàn):細胞體內(nèi)依賴于銅離子且受到調(diào)控的新的細胞死亡方式--“銅死亡”(Cuprotosis)。
在過去約30年中,細胞死亡研究已經(jīng)走了很長一段路,除了揭示基本生物學(xué)過程的機制外,它還帶來了針對癌癥和其他疾病(例如某些自身免疫性病理學(xué)或傳染病)的新療法,其中細胞凋亡、細胞焦亡、細胞壞死和鐵死亡,是近年來研究得最為廣泛的幾種形式。(點擊查看相關(guān)“細胞生物學(xué)”專題文章),這里我們了解下最新報道的“銅死亡”。
1. “銅死亡”
TODD R研究團隊揭示的“銅死亡”是一種全新的、受調(diào)控的細胞死亡方式。銅離子直接結(jié)合三羧酸(TCA)循環(huán)中的硫辛酰化組分,導(dǎo)致硫辛酰化蛋白的異常聚集,F(xiàn)e-S簇蛋白表達下降,從而引起蛋白毒性應(yīng)激反應(yīng)并導(dǎo)致細胞死亡。
這意味著可以針對相關(guān)分子,制定出一套更有效的銅離子載體治療方案,特別是針對FDX1、硫辛酰化水平高,依賴線粒體呼吸的腫瘤類型。因此,“銅死亡”作為最新提出的一種細胞死亡機制,引起學(xué)術(shù)界的振奮!
2.“銅死亡”調(diào)節(jié)機制
通過TODD R團隊的研究結(jié)果部分,我們可以了解到銅離子載體導(dǎo)致細胞死亡的機制,具體結(jié)果分析過程如下:
1)銅離子載體誘導(dǎo)的細胞死亡是新型的細胞死亡
首先研究團隊發(fā)現(xiàn),銅離子載體均能殺傷細胞,且使用銅離子載體Elesclomol,可調(diào)控銅介導(dǎo)的細胞死亡。那這種死亡方式,是否區(qū)別于已知的死亡方式(細胞凋亡、細胞壞死、鐵死亡)?為了進一步驗證,團隊通過敲除凋亡關(guān)鍵效應(yīng)因子Bax和BAK1,結(jié)果發(fā)現(xiàn)未能阻止銅離子載體誘導(dǎo)的細胞死亡,說明其細胞死亡機制明顯不同于已知的細胞死亡途徑。這些數(shù)據(jù)證實,銅離子載體誘導(dǎo)的細胞死亡是一種全新的細胞死亡形式。
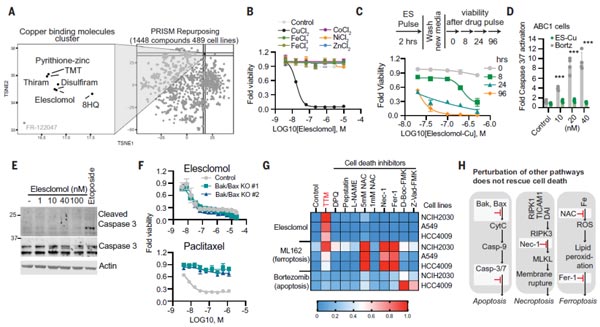
圖1. 銅離子載體誘導(dǎo)的細胞死亡是新型的細胞死亡 [1]
2)線粒體呼吸調(diào)節(jié)銅離子載體誘導(dǎo)的細胞死亡
緊接著,TODD R團隊發(fā)現(xiàn)線粒體呼吸在這種死亡機制中發(fā)揮關(guān)鍵作用。實驗數(shù)據(jù)表明,當(dāng)細胞依賴于線粒體呼吸時,其對銅離子載體的敏感性比進行糖酵解細胞高近1千倍;使用線粒體抗氧化劑、脂肪酸以及線粒體功能抑制劑處理細胞,會顯著影響細胞對銅離子載體的敏感性。
此外,線粒體解聚物FCCP對銅離子載體誘導(dǎo)的細胞死亡沒有影響;隨后團隊檢測了細胞不同類型的缺氧刺激,與銅離子載體處理對細胞耗氧率(OCR)的影響,數(shù)據(jù)表明,銅不會直接針對電子傳遞鏈(ETC),而是只在三羧酸(TCA)循環(huán)中發(fā)揮作用。這些論證表明,銅誘導(dǎo)細胞死亡所必需的是線粒體呼吸。
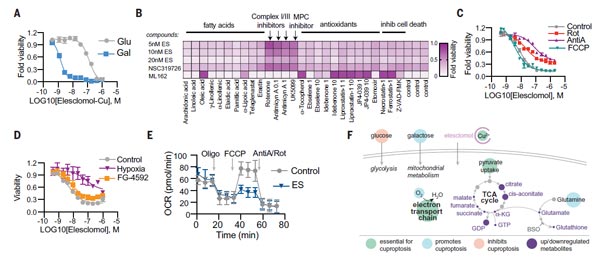
圖2. 線粒體呼吸調(diào)節(jié)銅離子載體誘導(dǎo)的細胞死亡 [1]
3)FDX1與蛋白硫辛酰化是銅離子載體誘導(dǎo)細胞死亡的關(guān)鍵介質(zhì)
為進一步明確細胞死亡的代謝路徑,研究團隊使用了全基因組CRISPR-Cas9功能缺失篩選,并采用不同結(jié)構(gòu)的銅離子載體進行處理,以提高篩選的普遍性。團隊對3千種代謝酶進行獨立的敲除篩選。
從以上的篩選中,他們找到了七個正調(diào)控基因(FDX1、LIAS、LIPT1、DLD、DLAT、PDHA1和PDHB)以及三個負調(diào)控基因(MTF1、GLS和CDKN2A),其中鐵氧還蛋白 1基因(ferredoxin 1,F(xiàn)DX1)和蛋白質(zhì)硫辛酰化(Protein lipoylation)是銅離子載體誘導(dǎo)細胞死亡的關(guān)鍵調(diào)控因子。通過個別基因敲除研究,缺失FDX1和硫辛酸合酶基因(lipoic acid synthase,LIAS)可增強對銅誘導(dǎo)的細胞死亡的抵抗力,進一步說明FDX1和蛋白硫辛酰化與銅離子載體誘導(dǎo)的細胞死亡之間的功能聯(lián)系。這些研究表明,F(xiàn)DX1與蛋白硫辛酰化是銅離子載體誘導(dǎo)細胞死亡的關(guān)鍵介質(zhì)。
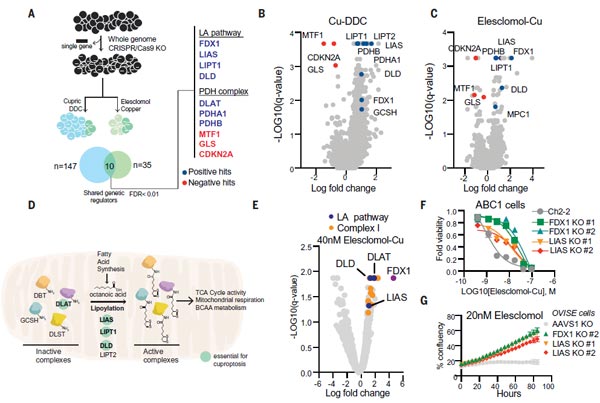
圖3. FDX1與蛋白硫辛酰化是銅離子載體誘導(dǎo)細胞死亡的關(guān)鍵介質(zhì) [1]
4)FDX1是蛋白硫辛酰化的上游調(diào)控因子
進一步的,研究團隊發(fā)現(xiàn),敲除FDX1或硫辛酰化相關(guān)酶均可以保護細胞免遭銅毒性,因此,他們提出猜想,F(xiàn)DX1可否為蛋白質(zhì)硫辛酰化的上游調(diào)節(jié)因子?通過癌癥依賴性圖譜(Cancer Dependency Map)等公共數(shù)據(jù)庫,他們發(fā)現(xiàn)FDX1和硫辛酰化相關(guān)酶與細胞存活高度相關(guān)。
隨后,他們對208例人類腫瘤標本進行FDX1和硫辛酸途徑蛋白的免疫組化(IHC)染色分析,結(jié)果顯示FDX1和硫辛酰化蛋白的表達高度相關(guān);WB實驗又進一步確認了FDX1的敲除會導(dǎo)致二氫硫辛酰胺轉(zhuǎn)乙酰基酶基因(Dihydrolipoamide S-Acetyltransferase,DLAT)和二氫硫辛酰胺S-琥珀酰轉(zhuǎn)移酶(DLST,Dihydrolipoamide S-Succinyltransferase)的蛋白硫辛酰化缺失;通過代謝物分析發(fā)現(xiàn),F(xiàn)DX1的缺失會導(dǎo)致丙酮酸和α-酮戊二酸的積累,琥珀酸的消耗,以及LIAS的關(guān)鍵底物S-腺苷甲硫氨酸(SAM)的積累。以上數(shù)據(jù)證實,F(xiàn)DX1參與調(diào)節(jié)蛋白的硫辛酰化過程。
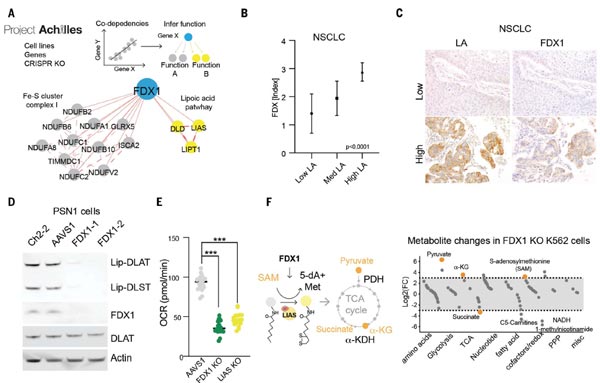
圖4. FDX1是蛋白硫辛酰化的上游調(diào)控因子 [1]
5)銅直接結(jié)合硫辛酰化DLAT并誘導(dǎo)其寡聚化
通過前面的實驗,作者建立了銅死亡和蛋白質(zhì)脂酰化之間的聯(lián)系,但只是間接證實FDX1和硫辛酰化的蛋白在銅死亡中的重要性,沒有建立直接的機制聯(lián)系。那么,銅是否直接與脂酰化蛋白質(zhì)結(jié)合呢?
為此,研究團隊在FDX1敲除細胞與正常細胞的裂解液中純化出DLAT和DLST兩種蛋白,結(jié)果發(fā)現(xiàn)正常細胞中的DLAT和Lip-DLST(硫辛酰化狀態(tài)),會直接與銅離子結(jié)合,但不與鈷或鎳樹脂結(jié)合。而FDX1敲除細胞中的DLAT和DLST(去硫辛酰化狀態(tài))則不與銅結(jié)合,表明蛋白的硫辛酰化修飾,是直接結(jié)合銅的必要條件。
此外,對Elesclomol敏感細胞的處理會增加DLAT寡聚體的水平,而對Elesclomol不敏感細胞系或FDX1敲除處理,只有在Elesclomol高濃度下才能導(dǎo)致DLAT寡聚。通過質(zhì)譜分析進一步發(fā)現(xiàn),銅離子載體處理還可導(dǎo)致Fe-S簇蛋白的水平降低。以上數(shù)據(jù)表明,銅直接結(jié)合硫辛酰化DLAT并誘導(dǎo)其寡聚化。
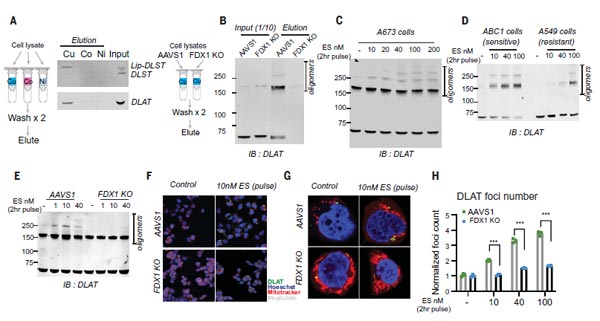
圖5. 銅直接結(jié)合硫辛酰化DLAT并誘導(dǎo)其寡聚化 [1]
6)銅過量導(dǎo)致的細胞死亡機制與銅離子載體誘導(dǎo)的細胞死亡機制是同一種機制
研究到這兒,通過以上1-5的驗證,銅死亡的機制已揭曉:銅離子載體誘導(dǎo)細胞內(nèi)銅離子水平上升至超過閾值,過量的銅促進硫辛酰化蛋白聚集,并使Fe-S簇蛋白不穩(wěn)定,導(dǎo)致細胞蛋白毒性應(yīng)激增高,最后誘導(dǎo)細胞死亡。但是,團隊再次提出疑問:銅離子載體誘導(dǎo)的細胞死亡與自然發(fā)生的銅穩(wěn)態(tài)功能障礙是否是同一種分子機制導(dǎo)致?
為探索其潛在聯(lián)系,研究者首先在人胚胎腎HEK 293T和ABC1細胞中過表達銅運載體SLC31A1(銅穩(wěn)態(tài)的關(guān)鍵靶點),數(shù)據(jù)表明,銅輸入顯著增強了細胞對線粒體呼吸相關(guān)蛋白的總消耗,導(dǎo)致蛋白硫辛酰化減少,F(xiàn)e-S簇蛋白水平降低,HSP70應(yīng)激蛋白水平升高。
更值得關(guān)注的是,過表達SLC31A1的細胞中,鐵死亡、壞死性凋亡、凋亡抑制劑和抗氧化劑,均都不能阻止銅誘導(dǎo)的細胞死亡,但銅螯合劑、FDX1 Knockdown和LIAS Knockdown卻可以減輕細胞死亡現(xiàn)象。
最后,研究者采用Wilson's disease小鼠模型發(fā)現(xiàn),老年Atp7b缺陷小鼠的肝臟中,蛋白的硫辛酰化水平和Fe-S簇蛋白的含量,均顯著降低,Hsp70蛋白則升高。通過多種模型分析,基因誘導(dǎo)下的銅過量導(dǎo)致的細胞死亡機制與銅離子載體誘導(dǎo)的細胞死亡機制是同一種機制。

圖6. 銅過量導(dǎo)致的細胞死亡機制與銅離子載體誘導(dǎo)的細胞死亡機制是同一種機制 [1]
3.“銅死亡”相關(guān)熱門靶點
目前該研究中,作者主要發(fā)現(xiàn)了多個與“銅死亡”代謝途徑特異性相關(guān)的調(diào)節(jié)基因。這些關(guān)鍵調(diào)節(jié)因子在“銅死亡”過程中的具體作用,以及銅毒性治療癌癥的有效性將是未來的研究熱點。
華美生物匯總了當(dāng)前與“銅死亡”相關(guān)信號通路中,大部分熱門靶點抗體產(chǎn)品,點擊靶點對應(yīng)貨號可查看相關(guān)試劑(具體詳情見下表)。
“銅死亡”熱門靶點抗體產(chǎn)品匯總:
| 信號通路 | 調(diào)控方式 | 關(guān)鍵靶點 | 貨號 | 宿主 | 反應(yīng)種屬 | 適用應(yīng)用 |
|---|---|---|---|---|---|---|
| 硫辛酰途徑 | 正調(diào)控 | DLD | CSB-PA006928LA01HU | Rabbit | Human, Mouse, Rat | ELISA, WB, IHC |
| CSB-PA783949 | Rabbit | Human, Mouse, Rat | ELISA, IHC | |||
| DLAT | CSB-PA006926LA01HU | Rabbit | Human | ELISA, WB, IP | ||
| CSB-PA445587 | Rabbit | Human, Mouse, Rat | ELISA, WB, IHC | |||
| 丙酮酸脫氫酶(PDH)復(fù)合物體途徑 | LIAS | CSB-PA012927LA01HU | Rabbit | Human | ELISA, WB, IHC | |
| PDHA1 | CSB-PA017715LA01HU | Rabbit | Human | ELISA, IHC, IF | ||
| CSB-PA247984 | Rabbit | Human | ELISA, WB, IHC | |||
| PDHB | CSB-PA017717ESR2HU | Rabbit | Human | ELISA, IHC | ||
| CSB-PA017717GA01HU | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC | |||
| 負調(diào)控 | GLS(GAM/GAC/KGA) | CSB-PA009528DA01HU | Human, Mouse | Rabbit | ELISA, WB, IHC | |
| CSB-PA969762 | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC | |||
| CSB-PA177709 | Human, Mouse, Rat | Rabbit | ELISA, IHC | |||
| MTF1 | CSB-PA013754LA01HU | Human | Rabbit | ELISA, WB, IHC, IF | ||
| P16-INK4A(CDKN2A) | CSB-PA005089LA01HU | Human | Rabbit | ELISA, IHC | ||
| CSB-PA003618 | Human, Mouse | Rabbit | WB, ELISA | |||
| 甘氨酸裂解酶系統(tǒng)(GCS)系統(tǒng)途徑 | / | GCSH | CSB-PA009335GA01HU | Human, Mouse, Rat | Rabbit | ELISA, WB, IHC, IF |
參考文獻:
1. Tsvetkov, Peter, et al. "Copper induces cell death by targeting lipoylated TCA cycle proteins." Science 375.6586 (2022): 1254-1261.






