蛋白激酶概述: 定義、類型、功能、激活機制等
日期:2024-01-31 09:01:35
1978年,第一個癌基因Rous肉瘤病毒(v-Src)的轉化因子被證明是一種蛋白激酶。1981年,人們發現PKC可被腫瘤促進劑磷脂醇 12-肉豆蔻酸13-乙酸酯(PMA)激活。這些發現證明了蛋白質磷酸化在疾病發病機制中的重要作用,并為針對蛋白激酶/磷酸酶的藥物開發打開了大門。
本文將介紹蛋白激酶的定義、類型、功能和研究。
1. 什么是蛋白激酶?
蛋白激酶(PKs)屬于激酶家族,是一種磷酸轉移酶,負責將ATP中的γ-磷酸轉移到底物蛋白質的特定氨基酸殘基上。這一過程被稱為蛋白質磷酸化,它是一個可逆的動態過程,由蛋白激酶和磷酸酶的競爭活動調節。在真核生物中,磷酸化主要發生在蛋白質的Ser和Thr殘基上,也發生在Tyr殘基上。
蛋白激酶具有相似的三維催化結構域。催化結構域由250到300個氨基酸組成,包括一個較大(通常為 α-螺旋狀的C端子域和一個較小(通常為 β-片狀)的N端子域 [1][10]。N 端和C端由肽支架連接,形成一個深槽,使肽底物和ATP分子能夠結合。ATP結合區可根據ATP結合情況和酶的活化狀態旋轉成“開”和“關”兩種構象 [2]。
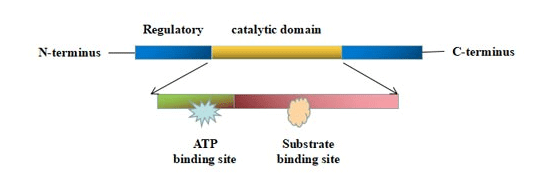
圖1. 蛋白激酶的結構
此外,蛋白激酶還具有非催化結構域,可以連接底物和招募其他信號蛋白。
2. 蛋白激酶有哪些類型?
蛋白激酶按其磷酸化的氨基酸殘基可分為五大類,包括絲氨酸/蘇氨酸蛋白激酶(ST-PKs)、酪氨酸蛋白激酶(TKs)、組氨酸特異性激酶、雙重特異性蛋白激酶和天冬氨酸/谷氨酸特異性蛋白激酶。
2.1 絲氨酸/蘇氨酸蛋白激酶
絲氨酸/蘇氨酸蛋白激酶是一個龐大的蛋白激酶家族,主要包括以下激酶:細胞周期蛋白依賴性激酶、絲裂原活化蛋白激酶、蛋白激酶D、納豆激酶、DNA依賴性蛋白激酶和極光蛋白激酶以及胰激肽原酶。
圖2. 鈣/鈣調蛋白依賴性蛋白激酶的晶體結構
細胞周期蛋白依賴性激酶: 細胞周期蛋白依賴性激酶(CDKs)是絲氨酸/蘇氨酸激酶。CDKs亞基需要與相應的細胞周期蛋白結合才能激活。激活的CDKs具有蛋白激酶活性,能使不同的底物蛋白磷酸化,從而啟動或調節細胞周期。
CDK 在細胞周期調控網絡中起著核心作用,其主要生物學作用是調控細胞周期的不同階段,從G1、S、G2到M期,并完成整個周期 [3]。
CDKs激活的底物主要包括視網膜膠質瘤蛋白、腫瘤抑制基因p107、p103等,具有促進細胞周期相變、啟動DNA合成、運行細胞分裂、促進細胞周期運轉等重要功能。CDK還參與調控神經細胞的轉錄、mRNA處理和分化。
表 1:模式生物中控制細胞周期的細胞周期蛋白依賴性激酶
| 物種 | 激酶 | 原名 | 功能 |
|---|---|---|---|
| 釀酒酵母(Saccharomyces cerevisiae) | Cdk1 | Cdc28 | All cell-cycle stages |
| 釀酒酵母(Schizosaccharomyces pombe) | Cdk1 | Cdc2 | All cell-cycle stages |
| 黑腹果蠅(Drosophila melanogaster) | Cdk1 | Cdc2 | M |
| Cdk2 | Cdc2c | G1/S, S, possibly M | |
| Cdk4 | Cdk4/6 | G1, promotes growth | |
| Xenopus laevis | Cdk1 | Cdc2 | M |
| Cdk2 | / | S, possibly M | |
| 人(Homo sapiens) |
Cdk1 | Cdc2 | M |
| Cdk2 | / | G1, S, possibly M | |
| Cdk4 | / | G1 | |
| Cdk6 | / | G1 |
表格信息來源于維基百科
絲裂原活化蛋白激酶: 有絲分裂原激活蛋白激酶(MAPK)是細胞中的一類絲氨酸/蘇氨酸蛋白激酶,是控制胚胎發生、細胞分化、細胞增殖和細胞死亡的重要組成部分。MAPK參與引導細胞對各種刺激(如有絲分裂原、滲透壓、熱休克和促炎細胞因子)的反應。
有絲分裂原活化蛋白激酶的基本形態沒有催化作用,需要磷酸化激活。MAP激酶受磷酸化級聯調節。它受由MAP激酶、MAPK激酶和MAPKK激酶組成的三級級聯調節 [4]。然而,每種 MAPK 激酶都可以被一種以上的 MAPKK 激酶激活,從而增加了MAPK信號的復雜性和多樣性。
哺乳動物至少能表達四組不同的MAPK: 細胞外信號相關激酶(ERK)-1/2;Jun N端激酶(JNK1/2/3);p38蛋白(p38α/?/γ/δ);ERK5。這些蛋白由特定的MAPKKs激活: ERK1/2由MEK1/2激活,p38由MKK3/6激活,ERK5由MKK4/7(JNK1/2)激活,ERK5由MEK5激活。
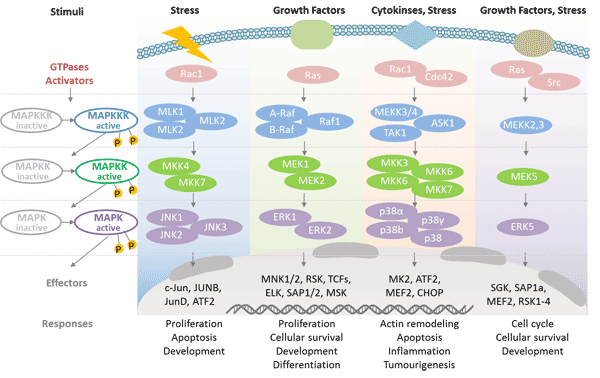
圖3. MAPK的級聯調控
蛋白激酶D:它屬于一類新的Ser/Thr蛋白激酶,由蛋白激酶 C(PKC)激活。PKD參與調控細胞功能,如細胞高爾基反向膜轉運、細胞生長、增殖、遷移、分化和凋亡 [5]。
● PKD與心血管:PKD可保護心肌,減少鈣超載對心肌細胞的損傷 [6]。激活PKD可增強心肌收縮力 [7]。
● PKD與神經元:PKD影響海馬神經元中轉鐵蛋白受體(TFR)和低密度受體相關蛋白(LRP)的轉運。
● PKD與免疫調節:PKD還參與調節炎癥因子的釋放。
● PKD與腫瘤細胞:PKD可通過調節基質金屬蛋白酶(MMP)的表達來促進腫瘤的侵襲和轉移。
胰激肽原酶 胰激肽原酶是人體內激肽酶家族中的一種蛋白水解酶。PK酶可通過激肽改善感覺或運動神經的傳導速度,抑制血小板聚集,防止血栓形成,擴張血管,增強微循環,減輕缺血和缺氧 [8]。PKase與前列腺素E1(PGE1)在改善糖尿病周圍神經病變(DPN)的病理變化和改善2型糖尿病患者的神經功能方面具有相同的功效。因此,PKase將成為治療糖尿病神經病變的潛在新藥 [9]。
2.2 酪氨酸激酶
酪氨酸激酶分為非受體酪氨酸蛋白激酶(NRTKs)、受體酪氨酸激酶(RTKs)和核酪氨酸蛋白激酶。
● 非受體酪氨酸蛋白激酶(NRTKs)
非受體酪氨酸蛋白激酶的重要結構域主要有 SH1、SH2、SH3、PH、PTB 等,它們在激酶的催化反應、酶定位、活性調控以及與其他分子的相互作用中發揮著重要作用。
非受體酪氨酸蛋白激酶分為11個家族,至少有30個成員。它們介導各種生長因子受體、細胞因子受體、淋巴細胞抗原受體和粘附分子整合素的信號轉導。
非受體酪氨酸蛋白激酶主要包括:
- SRC 激酶家族:原癌基因c-Src的產物,參與抗原受體、細胞因子受體和整合素介導的跨膜信號傳導。
- JAK 激酶家族(Janus 激酶):包括JAK1、JAK2、JAK3和TYK2。它們主要介導細胞因子受體的跨膜信號轉導。
- Sky/ZAP-70家族:包括Sky和zeta鏈相關蛋白-70。它介導淋巴細胞抗原受體和某些細胞因子受體的信號轉導,在淋巴細胞分化、發育和活化過程中具有重要作用。
此外,受體酪氨酸蛋白激酶還包括CSK家族、Tec家族和粘附斑塊激酶家族等。最后,我們總結了非受體酪氨酸蛋白激酶,并將其列于表2中。
表2:非受體酪氨酸蛋白激酶
| 家族 | 激酶 |
|---|---|
| ABL family | ABL1, ARG |
| ACK family | ACK1, TNK1 |
| CSK family | CSK, MATK |
| FAK family | FAK(PTK2), PYK2 |
| FES family | FES, FER |
| FRK family | FRK, PTK6(BRK), SRMS |
| JAK family | JAK1, JAK2, JAK3, TYK2 |
| SRC family | SRC, FGR, FYN, YES1, BLK, HCK, LCK, LYN |
| TEC family | TEC, BMX, BTK, ITK, TXK |
| SYK family | SYK, ZAP70 |
● 受體酪氨酸激酶(RTK)
是許多多肽生長因子、細胞因子和激素的高親和性細胞表面受體。目前已發現約20種不同的RTK類別。
表3: 受體酪氨酸激酶
| 分類 | 受體家族 | 激酶 |
|---|---|---|
| RTK class I | EGF receptor family | EGFR, ERBB2, ERBB3, ERBB4 |
| RTK class II | Insulin receptor family | INSR |
| RTK class III | PDGF receptor family | PDGFRA, PDGFRB |
| RTK class IV | VEGF receptors family | VEGFR1(FLT1), VEGFR2(KDR), VEGFR3(FLT4) |
| RTK class V | FGF receptor?family | FGFR1, FGFR2, FGFR3, FGFR4, FGFRL1 |
| RTK class VI | CCK receptor family | CCKAR, CCKBR |
| RTK class VII | NGF receptor family | NGFR |
| RTK class VIII | HGF receptor family | MET |
| RTK class IX | Eph receptor family | EPHA1, EPHA2, EPHA3, EPHA4, EPHA5, EPHA6, EPHA7, EPHA8, EPHA9, EPHA10, EPHB1, EPHB2, EPHB3, EPHB4, EPHB5, EPHB6 |
| RTK class X | AXL receptor family | AXL |
| RTK class XI | TIE receptor family | TIE1,TIE2 |
| RTK class XII | RYK receptor family | RYK |
| RTK class XIII | DDR receptor family | DDR1, DDR2 |
| RTK class XIV | RET receptor family | RET |
| RTK class XV | ROS receptor family | ROS1 |
| RTK class XVI | LTK receptor family | LTK |
| RTK class XVII | ROR receptor family | ROR1, ROR2 |
| RTK class XVIII | MuSK receptor family | MUSK |
| RTK class XIX | LMR receptor | LMTK2 |
| RTK class XX | Undetermined | / |
● 核酪氨酸蛋白激酶
涉及轉錄過程和細胞周期的調節。
2.3 組氨酸特異性蛋白激酶
組氨酸蛋白激酶是一種使底物蛋白中的組氨酸磷酸化的激酶,主要包括雙組分組氨酸蛋白激酶,它可以調節對環境刺激的反應。
雙組分哺乳動物組氨酸蛋白激酶:支鏈α-酮酸脫氫酶激酶(BCKDHK)和丙酮酸脫氫酶激酶(PDHK)。
2.4 雙特異性蛋白激酶
雙特異性蛋白激酶具有雙特異性激酶活性,既可為絲氨酸/蘇氨酸激酶,也可為酪氨酸激酶。
2.5 天冬氨酸/谷氨酸特異性蛋白激酶
蛋白質的酰基是磷受體。天冬氨酸/谷氨酸特異性蛋白激酶可將天冬氨酸/谷氨酸磷酸化。
3. 蛋白激酶的功能?
蛋白激酶通過磷酸化目標蛋白,在細胞內發揮分子開關的動態調節功能。它們在細胞信號傳導、細胞代謝調節和其他重要的細胞功能中形成了一個縱橫交錯的網絡。
蛋白激酶磷酸化是真核生物中最常見、最重要的翻譯后修飾之一。它在生物體的基因表達、細胞增殖、分化、凋亡、信號轉導、免疫調節、新陳代謝、運動、膜轉運、腫瘤發生等各個方面發揮著重要作用。
蛋白激酶主要通過兩種方式調控信號轉導。一種是通過磷酸化調節蛋白質的活性。另一種是通過蛋白質的逐步磷酸化放大信號,從而引起細胞對外界刺激的反應。
4. 蛋白激酶如何被激活?
蛋白激酶是通過其催化環的磷酸化激活的,而催化環的磷酸化又會激活一連串事件,導致亞基的不同氨基酸發生磷酸化。
與其他蛋白質的相互作用控制著蛋白激酶的活性。這可能發生在多個蛋白激酶之間的多層蛋白激酶級聯過程中。其他蛋白質與蛋白質之間的相互作用,如涉及 Ca2+/鈣調蛋白激酶的相互作用,則以依賴第二信使或受體-配體相互作用的方式調節激酶的活性。第三相互作用是噬蛋白酶對目標蛋白磷酸化水平的調節,噬蛋白酶是蛋白激酶的功能拮抗劑。
亞細胞定位在決定蛋白激酶的活性和特定物理功能方面起著重要作用。蛋白激酶的氨基酸序列基序或與激酶活性相關的其他蛋白質可能決定了蛋白激酶的亞細胞分布。
5. 蛋白激酶與疾病研究
蛋白激酶通過調節底物蛋白的活性、相互作用和穩定構象,間接調控細胞功能,在細胞信號傳導途徑、免疫反應、細胞周期調節和能量平衡等方面發揮著關鍵作用。
一旦磷酸化過程出現異常,相關的信號通路就會出現功能障礙。因此,蛋白質磷酸化異常與多種疾病相關,從癌癥 [11] 到炎癥性疾病、糖尿病并發癥 [12] 、感染性疾病、神經系統疾病、神經退行性疾病 [13] 和心臟功能障礙 [14]。
CDK 的異常表達可導致消化系統腫瘤和 [15] 血液系統腫瘤,如骨髓增生異常綜合征(MDS)和急性粒細胞白血病(AML)。此外,CDK 的異常表達還見于乳腺腫瘤 [16]和其他惡性腫瘤,如肺癌 [17]、食管鱗狀細胞癌 [18]、惡性黑色素瘤、脂肪肉瘤 [19]、髓母細胞瘤 [20]和前列腺癌。
蛋白激酶突變導致的疾病可通過靶向特定蛋白激酶進行治療。蛋白激酶已成為治療疾病的藥物靶點 [21],美國食品和藥物管理局(FDA)已批準多種蛋白激酶抑制劑用于癌癥治療。不同的蛋白激酶抑制劑用于不同的蛋白激酶。
蛋白酶抑制劑已被用于治療類風濕性關節炎(RA)。目前的蛋白酶抑制劑主要是非受體酪氨酸激酶(JAK)抑制劑、脾臟酪氨酸激酶(Syk)抑制劑、絲裂原活化蛋白激酶 p38 抑制劑 [22][23]。此外,一些研究人員發現,蛋白激酶是控制肥胖和糖尿病的開關。
由于酪氨酸激酶在細胞中的信號傳導作用,它也是一個重要的藥物靶點 [24]。目前使用的抗腫瘤 PTK 抑制劑主要是嘧啶類化合物、蛋白肽 PTK 抑制劑和萜類化合物。此外,胸苷激酶 1(TK1)已被證明在腫瘤的早期檢測、療效評估和預后判斷中具有重要作用。
參考文獻:
[1] Taylor SS, Radzio-Andzelm E. Three protein kinase structures define a common motif [J]. Structure. 1994;2:345–355.
[2] Sowadski JM, Epstein LF, Lankiewicz L, Karlsson R. Conformational diversity of catalytic cores of protein kinases [J]. Pharmacol Ther. 1999;82:157–164.
[3] Schlegel U, Schmidt-Wolf I G H, Deckert M. Primary CNS lymphoma: clinical presentation, pathological classification, molecular pathogenesis and treatment [J]. Journal of the Neurological Sciences, 2000, 181(1): 1-12.
[4] Chang L, Karin M. Mammalian MAP kinase signalling cascades [J]. Nature, 2001, 410(6824): 37-40.
[5] Wang Q J. PKD at the crossroads of DAG and PKC signaling [J]. Trends in Pharmacological Sciences, 2006, 27(6): 317-323.
[6] Koncz P, Szanda G, Fül?p L, et al. Mitochondrial Ca uptake is inhibited by a concerted action of p38 MAPK and protein kinase D [J]. Cell Calcium, 2009, 46(2): 122-129.
[7] Bardswell S C, Cuello F, Rowland A J, et al. Distinct Sarcomeric Substrates Are Responsible for Protein Kinase D-mediated Regulation of Cardiac Myofilament Ca2+ Sensitivity and Cross-bridge Cycling [J]. Journal of Biological Chemistry, 2010, 285(8): 5674.
[8] Ye L, Zhang S, Greder L, et al. Effective Cardiac Myocyte Differentiation of Human Induced Pluripotent Stem Cells Requires VEGF [J]. Plos One, 2013, 8(1): e53764.
[9] Jin Y P, Su X F, Li H Q, et al. The Therapeutic Effect of Pancreatic Kininogenase on Treatment of Diabetic Peripheral Neuropathy in Patients with Type 2 Diabetes [J]. Experimental & Clinical Endocrinology & Diabetes, 2016, 124(10): 618-621.
[10] Hanks S K, Quinn A M. Protein kinase catalytic domain sequence database: identification of conserved features of primary structure and classification of family members [J]. Methods in Enzymology, 1991, 200(200): 38-62.
[11] Liu X, Winey M. The MPS1 family of protein kinases [J]. Annual Review of Biochemistry, 2012, 81(81): 561.
[12] Geraldes P, King G L. Activation of protein kinase C isoforms and its impact on diabetic complications [J]. Circulation Research, 2010, 106(8): 1319-1331.
[13] Su S C, Tsai L H. Cyclin-Dependent Kinases in Brain Development and Disease [J]. Annual Review of Cell & Developmental Biology, 2011, 27(1): 465.
[14] Young L H, Zaha V G. AMP-activated Protein Kinase Regulation and Biological Actions in the Heart [J]. Circulation Research, 2012, 111(6): 800-814.
[15] Al-Aynati M M, Radulovich N, Ho J, et al. Overexpression of G1-S cyclins and cyclin-dependent kinases during multistage human pancreatic duct cell carcinogenesis [J]. Clinical Cancer Research, 2004, 10(19): 6598.
[16] Lucas J J, Domenico J, Gelfand E W. Cyclin-dependent kinase 6 inhibits proliferation of human mammary epithelial cells [J]. Molecular Cancer Research Mcr, 2004, 2(2): 105.
[17] Sun Y, Tang J. Expression of Cyclin E and CDK5 in lung cancer [J]. Journal of Dalian Medical University, 2003, 25: 4-6.
[18] Nozoe T, Takahashi I, Baba H, et al. Relationship between intracellular localization of p34 cdc2, protein and differentiation of esophageal squamous cell carcinoma [J]. Journal of Cancer Research & Clinical Oncology, 2005, 131(3): 179-183.
[19] Hostein I, Pelmus M, Aurias A, et al. Evaluation of MDM2 and CDK4 amplification by real-time PCR on paraffin wax-embedded material: a potential tool for the diagnosis of atypical lipomatous tumours/well-differentiated liposarcomas [J]. Journal of Pathology, 2004, 202(1): 95-102.
[20] Mendrzyk F, Radlwimmer B, Joos S, et al. Genomic and protein expression profiling identifies CDK6 as novel independent prognostic marker in medulloblastoma [J]. Journal of Clinical Oncology, 2005, 23(34): 8853-8862.
[21] Sebolt-Leopold J S, English J M. Mechanisms of drug inhibition of signaling molecules [J]. Nature, 2006, 441(7092): 457-62.
[22] Goldstein D M, Gabriel T. Pathway to the clinic: inhibition of P38 MAP kinase. A review of ten chemotypes selected for development [J]. Current Topics in Medicinal Chemistry, 2005, 5(10).
[23] Gracie J A, Leung B P, Mcinnes I B. Novel pathways that regulate tumor necrosis factor-α production in rheumatoid arthritis [J]. Current Opinion in Rheumatology, 2002, 14(3): 270.
[24] Rask-Andersen M, Zhang J, Fabbro D, et al. Advances in kinase targeting: current clinical use and clinical trial [J]. Trends in Pharmacological Sciences, 2014, 35(11): 604-620.
上一篇: 表觀遺傳組蛋白修飾途徑
下一篇: 蛋白質翻譯后修飾(PTM)










