癌癥中的信號轉導
我們身體的細胞也不斷地接收來自其他細胞的信號,同時生物體也不斷地接收來自環境的信號。這些信號對于維持細胞的生存和功能非常重要,能夠刺激重要的事件(如細胞分裂和分化)。信號轉導是一種通過細胞傳遞化學或物理信號的過程。
癌癥是指一類大量疾病的總稱,其特征是發展出異常細胞,這些細胞無法受控地分裂,并且具有滲入和破壞正常組織的能力。如圖1所示,大多數癌癥起源于上皮細胞(尤其是實體腫瘤),在肺、皮膚、乳房、肝臟和胰腺等器官中表現為癌癥。腫瘤擴大后,腫瘤核心失去氧氣和營養物質的供應,導致新血管的生長(血管生成),從而恢復對營養和氧氣的供應。隨后,腫瘤細胞可以發展出侵犯超越其正常界限的組織的能力,進入循環系統,并在其他部位形成新的腫瘤(轉移),這是惡性腫瘤的定義特征。
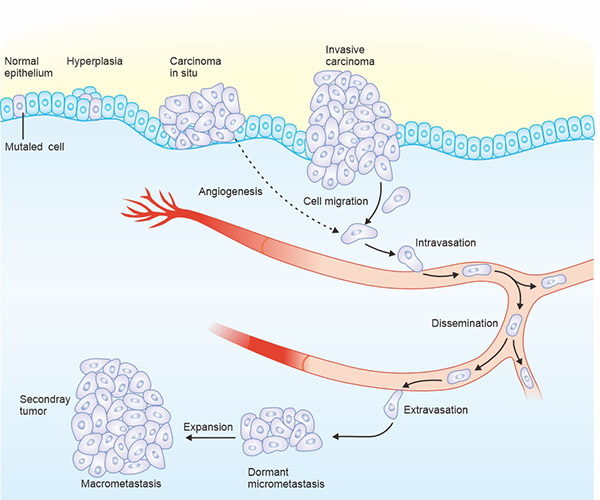
圖1. 癌癥惡化
*此圖表來自冷泉港醫學透視雜志 [1]
癌癥的發展涉及連續的遺傳和表觀遺傳改變。連續的遺傳改變導致異常的信號轉導。涉及癌癥的常見信號通路如下:
● Wnt信號通路:Wnt信號通路通過調節內源性干細胞的行為,對組織的發育和穩態起關鍵作用。異常的Wnt信號在許多癌癥的發起、維持和發展中被描述為一個關鍵因素,通過影響癌癥干細胞(Cancer Stem Cells,CSCs)的行為 [2]。Wnt通路通常分為β-連環蛋白依賴的(經典)信號和非依賴的(非經典)信號 [3]。非經典信號進一步分為非經典平面細胞極性(planar cell polarity,PCP)通路和非經典Wnt/鈣通路。
● Hedgehog(Hh)信號通路:Hedgehog(Hh)信號通路在從果蠅到人類的物種中高度保守。它對正常胚胎發育至關重要,并可能在各種人類癌癥中異常激活 [4] [5]。在哺乳動物中,Hh信號在早期胚胎發育的定型和極性事件以及特定器官和組織的形態發生中起調節作用。該通路隨后在大多數成體組織中被沉默,但可以在受傷后重新激活,促進修復和再生 [6]。
● 酪氨酸激酶受體通路:酪氨酸激酶受體(RTKs)是酪氨酸激酶的一個亞類,在細胞生長、運動、分化和代謝等各種細胞過程中發揮重要作用。目前,已知人類存在58種RTKs,如EGFR、HER2/ErbB2和MET等。在人體中,異常的RTK激活會導致多種人類疾病。其中,癌癥是最常見的,并通常由四種主要機制引起:功能增強突變、基因組擴增、染色體重排和/或自分泌激活 [7] [8]。
● 轉化生長因子-β通路:轉化生長因子-beta(TGF-β)信號傳導是一種重要的細胞通路,在組織維持中發揮關鍵作用。特別是在炎癥和腫瘤發生過程中,通過調節細胞生長、分化、凋亡和穩態來發揮作用 [9]。在進展的腫瘤中,TGF-β信號通路通過促進血管生成、上皮間質轉化和免疫逃逸來誘導腫瘤侵襲和轉移 [10]。
● 核因子-κB信號通路:核因子-κB(NF-κB)轉錄因子及其激活的信號通路是先天性和適應性免疫應答的中心協調者 [11]。NF-κB激活有兩條途徑,即經典和非經典途徑,需要與適配蛋白、磷酸化和泛素酶等復雜的分子相互作用 [12]。最近,人們越來越清楚NF-κB信號通路在癌癥的發展和進展中也起著關鍵作用。NF-κB提供了炎癥和癌癥之間的機制聯系,并且是控制潛在惡性和惡性細胞抵抗基于凋亡的腫瘤監測機制能力的重要因素。
參考文獻:
[1] Sever R, Brugge JS. Signal transduction in cancer [J]. Cold Spring Harb Perspect Med. 2015, 5(4):a006098.
[2] Yann Duchartre, Yong-Mi Kim, and Michael Kahn. The Wnt Signaling Pathway in Cancer [J]. Crit Rev Oncol Hematol. 2016, 99: 141-149.
[3] Zhan T, Rindtorff N, Boutros M. Wnt signaling in cancer. Oncogene [J]. 2017, 36(11):1461-1473.
[4] Nüsslein-Volhard C, Wieschaus E. Mutations affecting segment number and polarity in Drosophila [J]. Nature. 1980, 287(5785): 795-801.
[5] Ingham PW, McMahon AP. Hedgehog signaling in animal development: paradigms and principles [J]. Genes Dev. 2001, 15(23): 3059-87.
[6] McMillan R, Matsui W. Molecular pathways: the hedgehog signaling pathway in cancer [J]. Clin Cancer Res. 2012, 18(18):4883-8.
[7] Lemmon MA, Schlessinger J. Cell signaling by receptor tyrosine kinases [J]. Cell. 2010, 141:1117-34.
[8] Zhenfang Du & Christine M. Lovly. Mechanisms of receptor tyrosine kinase activation in cancer [J]. Mol Cancer. 2018, 17, 58.
[9] Itatani Y, Kawada K, Sakai Y. Transforming Growth Factor-β Signaling Pathway in Colorectal Cancer and Its Tumor Microenvironment [J]. Int J Mol Sci. 2019, 20(23):5822.
[10] Chen Y, Di C, Zhang X et al. Transforming growth factor β signaling pathway: A promising therapeutic target for cancer [J]. J Cell Physiol. 2020, 235(3):1903-1914.
[11] Michael Karin. Nuclear factor-κB in cancer development and progression [J]. Nature. 2006, 441, pages431-436.
[12] Mohammad Reza Zinatizadeh, Bettina Schockb, Ghanbar Mahmoodi Chalbatani. The Nuclear Factor Kappa B (NF-kB) signaling in cancer development and immune diseases [J]. Genes & Diseases. 2020.






