胰腺癌
胰腺癌是美國第四大癌癥死因。它是一種嚴重的疾病,惡性細胞在胰腺組織中形成。胰腺是一個位于腹部深處的器官,橫跨在胃的下部和脊柱前方(圖1)。它主要的功能是產生消化液和激素,用于消化和吸收食物以及吸收營養物質。
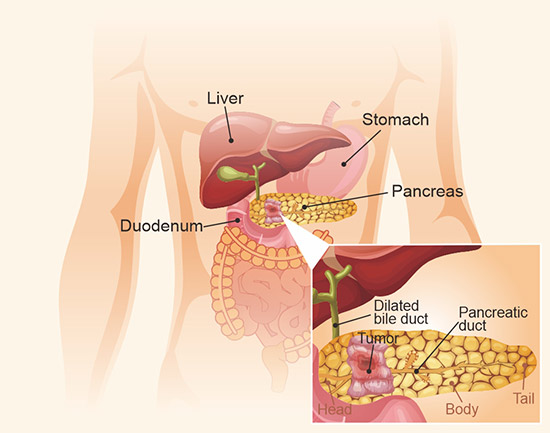
圖1. 胰腺結構示意圖
*此圖表來自JAMA [1] 上發表的文章
胰腺癌是指胰腺細胞在胰腺內發生異常的DNA突變,導致細胞分裂和不受控制的生長,形成腫瘤。胰腺可以發生兩種類型的生長,包括惡性和非惡性腫瘤。胰腺中最常見的癌癥類型始于胰腺內攜帶消化酶的管道的細胞(胰導管腺癌)。由于胰腺位于腹腔深處,胰腺癌很難檢測和診斷。腫瘤可能引起黃疸、疼痛、食欲減退、胰腺炎或意外的體重減輕等癥狀。
胰腺癌的分子病理學主要由KRAS激活突變主導,這種突變在超過90%的腫瘤中存在。TP53、CDKN2A和SMAD4的失活突變在50-80%的胰腺癌中出現,而其他基因,包括ARID1A和TGFBR2,在約10%的腫瘤中突變 [2-5]。本文根據NCG提供的信息,列出了與胰腺癌相關的部分靶點。NCG是一個用于分析癌癥基因的重復性、同源性和網絡特性的網絡資源。
在這里,我們展示了胰腺癌分子病理學中涉及的幾個關鍵靶點,包括:
● CDKN2A(cyclin-dependent kinase inhibitor 2A),也稱為p16-INK4a、MTS-1或CDK4I,是一個腫瘤抑制基因,通過抑制負責啟動G1/S期轉變的cyclinD-CDK4和cyclinD-CDK6復合物來調節細胞周期進程。它是癌癥中最常見的改變基因之一,在散發性胰腺癌中突變的發生率令人印象深刻,約有98%的病例發生失活 [6] [7]。
● SMAD4(SMAD家族成員4)是一種腫瘤抑制蛋白,在TGFβ家族受體激活后,以異三聚體形式轉位到細胞核,激活基因表達并引起生長抑制 [8]。在胰腺導管腺癌中,KRAS、TP53、SMAD4和CDKN2A等四個驅動基因被報道為代表性的與癌癥相關基因 [9]。此外,SMAD4的突變在約50%的胰腺癌中發生,大多數導致蛋白質失活。
● ARID1A(AT-rich interactive domain containing protein 1A)是SWI/SNF復合物的一部分,是一個多亞基復合物,通過依賴ATP的方式轉移、插入或驅逐核小體來重塑染色質。ARID1A在胰腺導管腺癌中常見突變,并且新興研究表明,ARID1A以一種區段特異的方式抑制胰腺腫瘤發生。此外,在導管細胞中,這個過程似乎與MYC促進的蛋白質合成有關 [10]。
● KMT2C(Lysine N-methyltransferase 2C),也稱為髓系/淋巴系或混合譜系白血病蛋白3,是KMT2家族組蛋白賴氨酸甲基轉移酶的成員,包括KMT2A、KMT2B、KMT2C、KMT2D、KMT2E、KMT2F、KMT2G和KMT2H [11]。其中,KMT2C和KMT2D是COMPASS復合物中的單甲基轉移酶,兩者都以H3K4為靶標進行表觀遺傳調控 [12]。幾項研究觀察到在胰腺癌患者中存在KMT2C(錯義)突變和KMT2D(錯義)突變。此外,根據Sausen等人的報道,KMT2C/D的無義/錯義突變與胰腺癌患者的較好預后相關 [13]。
● RNF43(ring finger 43)作為一種跨膜E3泛素連接酶,通過泛素化Wnt受體frizzled來下調Wnt/β-catenin通路 [14]。RNF43的突變已在多種腫瘤中被發現,包括囊性胰腺腫瘤。
參考文獻:
[1] Alexandra Moore and Timothy Donahue. Pancreatic Cancer [J]. JAMA. 2019, 322 (14): 1426.
[2] Wang, L. et al. Whole-exome sequencing of human pancreatic cancers and characterization of genomic instability caused by MLH1 haploinsufficiency and complete deficiency [J]. Genome Res. 2012, 22, 208–219.
[3] Waddell, N. et al. Whole genomes redefine the mutational landscape of pancreatic cancer [J]. Nature. 2015, 518, 495–501.
[4] Bailey, P. et al. Genomic analyses identify molecular subtypes of pancreatic cancer [J]. Nature. 2016, 531, 47–52.
[5] Jorg Kleeff, Murray Korc, Minoti Apte et al. Pancreatic cancer [J]. Nat Rev Dis Primers. 2016, 21 (2):16022.
[6] Schutte, M.; Hruban, R.H.; Geradts, J. et al. Abrogation of the RB/p16 tumor-suppressive pathway in virtually all pancreatic carcinomas [J]. Cancer Res. 1997, 57, 3126–3130.
[7] Jonas Cicenas, Kotryna Kvederaviciute, Ingrida Meskinyte et al. KRAS, TP53, CDKN2A, SMAD4, BRCA1, and BRCA2 Mutations in Pancreatic Cancer [J]. Cancers. 2017, 9 (12): 42–.
[8] Cao, D.; Ashfaq, R.; Goggins, M.G. et al. Differential expression of multiple genes in association with MADH4/DPC4/SMAD4 inactivation in pancreatic cancer [J]. Int. J. Clin. Exp. Pathol. 2008, 1, 510–517.
[9] Takahiro Yokose, Minoru Kitago, Sachiko Matsuda et al. Combination of KRAS and SMAD4 mutations in formalin-fixed paraffin-embedded tissues as a biomarker for pancreatic cancer [J]. Cancer Sci. 2020, 111(6):2174-2182.
[10] Sam C Wang, Ibrahim Nassour, Shu Xiao et al. SWI/SNF component ARID1A restrains pancreatic neoplasia formation [J]. Gut. 2019, 68:1259-1270.
[11] Allis CD, Berger SL, Cote J et al. New nomenclature for chromatin-modifying enzymes [J]. Cell. 2007, 131:633–6.
[12] Rokutan, H.; Hosoda, F.; Hama, N. et al. Comprehensive mutation profiling of mucinous gastric carcinoma [J]. J. Pathol. 2016, 240, 137–148.
[13] Sausen, M.; Phallen, J.; Adleff, V. et al. Clinical implications of genomic alterations in the tumour and circulation of pancreatic cancer patients [J]. Nat. Commun. 2015, 6, 7686.
[14] Xiao Yan Chang, Yan Wu, Ying Jiang et al. RNF43 Mutations in IPMN Cases: A Potential Prognostic Factor [J]. Gastroenterology Research and Practice. 2020, 1457452.






