Western Blotting(WB)實驗流程
Western blotting(蛋白質印跡)使用抗體從復雜樣品中識別單個蛋白質,并進行半定量分析。首先,通過SDS-PAGE(聚丙烯酰胺凝膠電泳)將蛋白質根據大小分離。接下來,通過施加電流將蛋白質從凝膠轉移到膜上。最后,根據特定的抗原-抗體結合,可以通過特異性一抗檢測和分析負載了抗原的印跡膜。
蛋白質印跡主要用于目標蛋白質特異性表達的定性或半定量分析,蛋白質-蛋白質或蛋白質-DNA相互作用的后續分析,以及蛋白質修飾的鑒定分析。
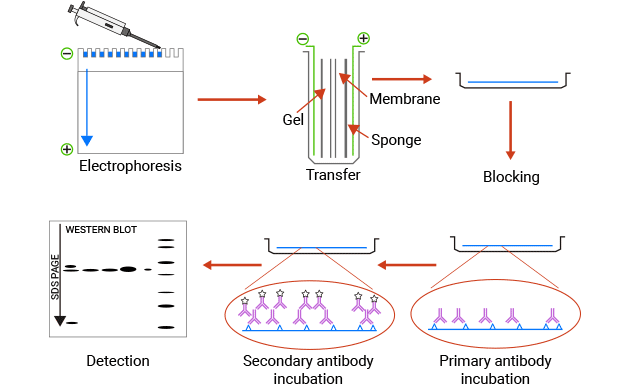
圖1. WB的簡單過程
1. 蛋白質樣品準備
1.1 蛋白質樣品來源
蛋白質樣品可以是可溶性蛋白質液體、細胞/組織裂解液或免疫沉淀的蛋白質。不同樣品的蛋白質加載量有所不同,一般來說,純化蛋白質的推薦加載量不超過100 ng,細胞/組織裂解液的加載量可為10-40 μg。
1.2 蛋白質樣品準備
通常情況下,從動物或植物組織或細胞中提取復雜的蛋白質成分,提取過程中應遵循以下原則:
a. 根據不同蛋白質的特性選擇合適的提取方法。
b. 使用適當的方法最大限度地提取目標蛋白質。
c. 在低溫下進行操作,并添加蛋白酶抑制劑以防止蛋白質降解。
d. 選擇適當的蛋白質裂解液以保持蛋白質的溶解性。
e. 將蛋白質樣品儲存于-80℃,避免反復凍融,盡快進行檢測。
細胞培養物的裂解液制備
a. 當細胞密度達到80%時,將細胞培養皿放在冰上,并用冰冷的磷酸鹽緩沖液(PBS)洗滌細胞3次。
b. 準備含有蛋白酶抑制劑的裂解液。常用的蛋白酶抑制劑如下表(表2)所示。應根據實驗要求選擇合適的蛋白酶抑制劑。最常用的蛋白酶抑制劑是PMSF(工作濃度為1 mM),它具有高毒性,使用時應自我保護。它在水中的半衰期非常短,因此應在使用前添加。
c. 向一個10 cm 培養皿中加入含有蛋白酶抑制劑的1 mL蛋白質裂解液,輕輕搖晃,并在冰上裂解15-30分鐘。
d. 使用冷的塑料細胞刮刀將貼壁細胞從培養皿上刮下,然后輕輕將細胞懸浮液轉移到一個1.5 mL EP管中,將管放在冰上。此時應避免產生氣泡。
e. 在4℃下以12000 rpm離心10-15分鐘。
f. 輕輕吸取上清液放入另一個新的離心管中,放在冰上備用。注意不要吸取上層浮在上方的脂質等雜質。
g. 在蛋白質定量后,加入適量的6×樣品加載緩沖液,95℃下煮沸5分鐘,然后以12000 rpm離心30秒,最后在-20℃保存。
樣品準備注意事項:
所有步驟必須在低溫下進行!低溫!低溫!
a. 對于懸浮生長的細胞,以2500 rpm離心3分鐘進行收集,然后進行細胞洗滌和裂解程序。
b. 對于接受藥物處理的細胞,尤其是與凋亡相關的研究樣品,還應收集培養基上清液。
c. 不建議使用蛋白酶來消化和收集細胞,因為這可能會引入蛋白質雜質或對某些特定蛋白質(特別是膜表面蛋白質)造成損傷,從而干擾實驗結果。
d. 裂解液中可能會出現一種黏稠的透明凝膠,這是基因組DNA的成分。進行實驗時取上清液。然而,當目標蛋白質緊密結合于基因組時,需要通過超聲波破碎或注射器吸取的方式破壞凝膠,然后取上清液進行后續實驗,以避免蛋白質損失。
e. PMSF在水溶液中不穩定,通常在30分鐘內降解一半。活性喪失的速度隨pH值的增加而增加,25℃下的失活速率高于4℃。如果樣品處理時間超過1小時,則需要再次添加。
f. 注意細胞狀態和細胞傳代次數的影響。不同代數的癌細胞存在異質性,因此細胞形態、遷移和侵襲能力可能會發生變化,從而導致某些基因表達的變化。
一方面,由于細胞本身的一定異質性,在一段時間的培養后,細胞的整體特性逐漸以適者生存的方式發生變化。
另一方面,在細胞培養過程中,由于培養條件的變化或外部刺激的存在,例如培養試劑的更換、消化和傳代、細胞污染以及一些化學和物理刺激,細胞中相關基因的表達可能會受到影響,最終影響實驗結果。
在使用腫瘤細胞進行實驗時,應首先保存,并盡量使用同一代數的相關細胞進行相關的實驗研究,以避免由于過度傳代而導致的細胞異質性,并最終導致實驗結果不一致。
組織的裂解液制備
a. 收集新鮮樣品,并用生理鹽水或PBS洗滌,然后切割成適當大小的塊狀。可以在冰上使用1-2 mL均質器進行組織均質,或者加入液氮進行研磨。推薦使用液氮研磨,因為組織塊不容易損壞,并且在均質過程中會產生摩擦熱。
b. 準備含有蛋白酶抑制劑的裂解液。
c. 將含有蛋白酶抑制劑的適量裂解液(50 mg/500 μL)加入研磨的組織樣品中,并將管放在冰上裂解15-30分鐘,同時間歇性混合以充分裂解。
d. 在4℃下以12000 rpm離心10-15分鐘。
e. 小心取出EP管,將上清液吸取到一個新的管中。注意不要吸取上層浮在上方的脂質等雜質,然后放在冰上備用。
f. 在4℃下以12000 rpm離心10-15分鐘。

圖2. 裂解液制備過程
1.3 蛋白裂解物的選擇
對于大多數樣品,RIPA裂解緩沖液可用于快速細胞裂解。
表1. RIPA裂解緩沖液的組成
| RIPA裂解緩沖液 | |
|---|---|
| Tris-HCl | 50 mM |
| NACI | 150mM |
| EDTA | 1 mM |
| SDS(W/V) | 0.1% (W/V) |
| SDS(W/V) | 0.1% (W/V) |
| 膽酸鈉1% | 1% (W/V) |
| Triton X-100% | 1% (W/V) |
| 根據實驗目的,可以向RIPA裂解緩沖液中添加適當的蛋白酶抑制劑。 | |
蛋白質裂解液的主要成分及其作用如下:
具有一定pH范圍的緩沖液可以為蛋白質提供穩定的環境,并增加蛋白質的溶解性。常用的是Tris-HCl或HEPES緩沖液,pH值在生理pH范圍內。 Tris-HCl緩沖液(pKa = 8.1)的pH范圍為7.0-9.2,對溫度敏感。HEPES緩沖液(pKa = 7.55)的pH值范圍為6.5-8.5。
適當的鹽離子濃度可以維持蛋白質的溶解性。選擇近似生理狀態下的150 mM NaCl不會影響蛋白質的溶解和蛋白質之間的相互作用。
螯合金屬離子用于防止蛋白質提取物過于黏稠,降低溶解性。此外,螯合劑還可以與某些酶相互作用,抑制酶活性。
添加一定量的還原劑可以保護蛋白質上的游離巰基免受氧化,從而避免蛋白質聚集或變性。β-巰基乙醇和二硫蘇糖醇(DTT)是常用的還原劑,后者比前者更強大。通常,β-巰基乙醇具有揮發性,并且在加入緩沖液后會在短時間內被氧化,從而可能影響蛋白質的活性,其工作濃度為5-20 mM/L。DTT具有更強的還原能力,在氧化后可以形成穩定的分子內二硫鍵而不影響蛋白質的巰基。其工作濃度為0.5-1 mM/L。基本上,長期儲存建議使用DTT,但DTT溶液不穩定,需在制備后立即使用。
表面活性劑是一種界面活性劑,其疏水段插入到膜的磷脂雙層中,改變其滲透性,最終破壞膜結構。因此,表面活性劑的強度直接決定了裂解細胞的能力。裂解液中使用的表面活性劑主要分為兩類:陰離子表面活性劑和非離子表面活性劑。常用的表面活性劑如下:
SDS:陰離子表面活性劑,具有很強的破壞力,基本上可以溶解所有蛋白質,并破壞其天然構象結構。SDS與蛋白質的結合比例為1.4:1,可以有效覆蓋蛋白質本身的電荷。SDS的臨界膠束溫度稍高,因此在低溫下可能出現沉淀,并且在存在鉀鹽的情況下沉淀會更明顯。此外,溶液的離子強度越強,離子性表面活性劑的臨界膠束濃度越低,使蛋白質更易溶解。
NaDOC:一種離子性表面活性劑,比SDS弱一些。
Triton X-100:一種非離子表面活性劑。它可以破壞蛋白質與脂質之間的相互作用,但不會使蛋白質變性,也不會破壞蛋白質與蛋白質之間的連接。它可以保持蛋白質的天然構象。它的臨界膠束濃度較低,可以在64℃時觀察到兩相分離現象。
NP-40:一種非離子表面活性劑,對細胞核膜的破壞較弱,但對蛋白質具有較強的結合能力,可以保證蛋白質的溶解度和結構穩定性,因此特別適用于在非變性條件下溶解膜蛋白質。
Tween 20:一種溫和的非離子表面活性劑,對蛋白質的溶解能力較差,不會破壞蛋白質結構,不是蛋白質裂解液的常見成分。
選擇表面活性劑取決于要提取的蛋白質的性質和實驗目的。選擇表面活性劑時需要考慮許多因素,包括充分裂解細胞和溶解蛋白質,以及提取蛋白質的狀態(變性或保持天然狀態)。
在蛋白質提取過程中,細胞和組織的破壞會釋放大量的蛋白酶。為了抑制蛋白酶活性,樣品必須保持在低溫下,并加入適量的蛋白酶抑制劑以防止目標蛋白質的降解。
表2. 常用的蛋白酶抑制劑
| 蛋白酶抑制劑 | 功能 | 作用濃度 | 特性 |
|---|---|---|---|
| PMSF | 絲氨酸蛋白酶抑制劑 半胱氨酸蛋白酶抑制劑 |
0.5-1 mM | MSF在水中的半衰期很短,需要在使用前不久添加。劇毒,實驗操作時應注意自我保護 |
| APMSF | 絲氨酸蛋白酶抑制劑 | 0.4-4 mM | - |
| Pepstatin | 天冬氨酸蛋白酶抑制劑 | 1 μM | -4℃保存1周,-20℃保存1個月;避免重復凍融循環。 |
| Leupeptin | 絲氨酸蛋白酶抑制劑和半胱氨酸蛋白酶抑制劑 | 10-100 μM | -4℃保存1周,-20℃保存1個月;避免重復凍融循環。 |
| Aprotinin | 絲氨酸蛋白酶抑制劑 | 0.01-0.03 μM | -4℃保存1周,-20℃保存1個月;避免重復凍融循環。 |
| Na3VO4 | 磷酸酶抑制劑 | 1 mM | 需要被激活。溶解后加酸調節pH至10,加熱煮沸至無色,室溫冷卻,再調節pH至10。重復上述步驟,直到溶液保持無色,pH穩定在10,等分并保存在-20°C。 |
| NaF | 磷酸酶抑制劑 | 10-20 mM | - |
2. 蛋白質定量
為了定量樣品中感興趣的蛋白質,需要確定樣品中總蛋白質的含量。當總蛋白質的含量保持恒定時,目標蛋白質的表達水平的差異就會體現出來。
表3. 常用的化學定量方法
| 方法 | 原理 | 干擾因素 | 特性 |
|---|---|---|---|
| 布拉德福定量法 | 在酸性條件下,蛋白質與G-250的結合使染料的最大吸收波長發生偏移。在一定范圍內,蛋白質含量與595 nm吸收峰呈線性關系。 | 該試驗受到強堿性緩沖液和高濃度洗滌劑的干擾 | 快速、高靈敏度,最低檢出限為1μg。該蛋白-染料配合物消光系數高,顏色穩定。該分析主要用于堿性或芳香氨基酸的檢測,因為它對蛋白質有很高的選擇性。 |
| 定量試劑盒 | 在堿性條件下,蛋白質將Cu2+還原為Cu+, Cu+與BCA反應形成紫色絡合物。該配合物在562 nm處的吸光度與蛋白質濃度成線性關系。 | 該方法適用于高脂含量樣品的檢測,并能耐受一定濃度的洗滌劑。 | 快速靈敏,抗干擾能力強,檢出限可達0.5 μg。與Bradford試驗相比,蛋白質之間的差異較小 |
| 勞里測定法 | 在堿性條件下,Cu2+與蛋白質中的肽鍵反應形成絡合物,使Folin-Ciocalteu試劑還原,生成藍色絡合物。顏色的深淺和蛋白質濃度之間存在線性關系。 | - | 標準曲線不是一條直線,不同蛋白質的顏色深淺不同,檢測時間較長。 |
| 紫外-可見分光光度法(UV - Vis或UV/Vis) | 根據蛋白質的物理性質和朗伯-比爾定律,在給定波長處的吸光度與蛋白質濃度成線性關系。 | 該試驗受不同蛋白質中色氨酸和酪氨酸水平的干擾。 |
2.1 用Bradford方法繪制標準曲線
a. 準備牛血清白蛋白(BSA)標準品:
將0.05克BSA溶解在5毫升PBS中,得到10毫克/毫升的BSA標準品。
b. 準備庫馬司亮藍G-250染色液:
將50毫克庫馬司亮藍G-250溶解在25毫升90%乙醇中,加入50毫升磷酸(85%),用純水稀釋至500毫升。避光保存。
c. 稀釋蛋白樣品:
對蛋白樣品進行1:10、1:20和1:40的稀釋。
d. 將BSA標準品稀釋至以下濃度。
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | |
| 濃度(mg/mL) | 0 | 0.05 | 0.075 | 0.1 | 0.15 | 0.2 | 0.3 | 0.4 |
e. 將稀釋后的BSA標準溶液和蛋白樣品各加入微孔板條的孔中,每孔加入20 μL,然后加入180 μL G250染色溶液,并充分混合。
f. 使用分光光度計在595 nm波長下測量吸光度,并制作標準曲線以計算蛋白質濃度。
2.2 BCA法(請參考相應試劑盒的說明)
a. 準備牛血清白蛋白(BSA)標準品:
a. 將BCA試劑A與試劑B按50:1(體積比)的比例混合制備BCA工作試劑,并在室溫下孵育24小時。
b. 將標準品溶解至與樣品使用的相同溶劑相同濃度的0.5 mg/L。
c. 逐漸加入梯度體積的標準溶液(0 μL,1 μL,2 μL,4 μL,8 μL,12 μL,16 μL,20 μL)到微孔板孔中,并向每個孔中加入標準稀釋液,使最終體積為20 μL。
d. 向每個孔中加入200 μL BCA工作試劑,并在37℃下孵育30分鐘。
e. 使用分光光度計在562 nm波長下測量吸光度。
f. 根據標準曲線計算蛋白質濃度。
3. 蛋白樣品制備
蛋白質的變性涉及破壞蛋白質的三級結構并暴露抗原表位,有助于抗體與目標蛋白質的結合和后續檢測。為了變性蛋白質,將蛋白樣品與2倍的樣品加載緩沖液按體積比1:1或6倍的樣品加載緩沖液按體積比5:1混合,將混合溶液在95℃下煮沸5分鐘。
膜蛋白在高溫下往往會聚集和沉淀,應在37℃下處理30分鐘。
表4. 加載緩沖器組件
| 6×樣品上樣緩沖液 | |
|---|---|
| Tris-HCl (pH 6.8) | 6% (V×/V) |
| SDS | 4% (W/V) |
| Bromophenol blue | 0.2% (W/V) |
| Glycerol | 20% (V/V) |
| DTT | 9% (V/V) |
| 注:蛋白質樣品的上樣量為每孔10-40 μg。過量的蛋白質會導致皮膚發黑。 | |
4. SDS-PAGE
4.1 SDS-PAGE凝膠
聚丙烯酰胺凝膠是由丙烯酰胺和亞甲基雙丙烯酰胺的聚合形成的,這導致形成具有分子篩性質的凝膠結構網絡。蛋白質被大量帶有負電荷的SDS膠束包裹,覆蓋了蛋白質本身的電荷,并為蛋白質提供了均勻的電荷質量比。SDS-PAGE的分辨率與丙烯酰胺和亞甲基雙丙烯酰胺交聯劑的濃度相關。不同濃度交聯劑形成的分子篩具有不同的孔徑,根據分子量可以提供各種不同的分離條件(詳見下文)。
表5. 凝膠百分比和相應的蛋白質大小
| 接枝率 | 蛋白質大小(kDa) |
|---|---|
| 8% | 70-200 |
| 10% | 25-70 |
| 12% | 20-55 |
| 15% | 15-45 |
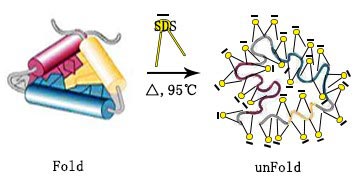
表6. 丙烯酰胺凝膠的組成與功能
| 成分 | 功能 |
|---|---|
| 丙烯酰胺 | 丙烯酰胺單體可以聚合形成聚丙烯酰胺凝膠。 |
| N,N-Methylenebisacrylamide | 誘導長聚合物鏈之間的交聯形成三維網絡。 |
| Tris-HCl Buffer | 保持pH穩定。 |
| APS | 促進交聯并提供自由基,促進丙烯酰胺和N,N-亞甲基雙丙烯酰胺的聚合。 |
| TEMED | 催化自由基的形成,加速聚合。 |
4.2 電泳緩沖液制備
常規的SDS-PAGE是一種用于分離分子量在30 kDa到250 kDa之間的蛋白質的強大工具。根據蛋白質的分子量選擇適當的分離凝膠濃度(見表5)。
表7. 電泳緩沖液(1L)組分
| 試劑 | 質量 (g) |
|---|---|
| 甘氨酸 | 14.4 |
| 三羥甲基氨基甲烷 | 3 |
| 三羥甲基氨基甲烷 | 1 |
| 加入ddH2O,充分混合,pH值8.3。 | |
在甘氨酸-三氨基甲烷凝膠電泳系統中,使用恒定功率,將濃縮凝膠以60-80 V運行,分離凝膠以100-120 V運行。電壓越低,運行速度越慢,可以獲得更好的分離效果。
然而,常規的甘氨酸-三氨基甲烷凝膠系統對于分離分子量較小(<30 kDa)的小分子蛋白質的分辨率不高。三甘氨酸的電子遷移率和解離常數優于甘氨酸,這在濃縮凝膠中為小分子蛋白質提供了更好的濃縮效應,在分離凝膠中獲得更高的分辨率。
表8. 推薦的電泳緩沖液用于小分子蛋白質
| 試劑 | 質量(g) | 注釋 | |
|---|---|---|---|
| 陽極緩沖(1L緩沖系統) | Tris | 24.228 | 將Tris溶于ddH2O中,充分混合,調整pH至8.9。 |
| 陰極緩沖器(1L緩沖系統) | Tricine | 17.92 | 將試劑溶解在ddH2O中,充分混合。 |
| Tris | 12.114 | ||
| SDS | 1 |
我們建議在三甘氨酸-三氨基甲烷凝膠中以恒定電壓(60-100 V)進行電泳。
4.3 蛋白質標記物和負載對照
根據實驗要求,使用適當的對照非常重要。
分子量指示劑:覆蓋適當范圍分子量的蛋白質標記物可以指示蛋白質的分子量,并在一定程度上反映電泳效果和膜轉移效率。根據不同特點,常用的標記物大致可分為三類:未染色標記物、預染色標記物和顯影標記物。
表9. 不同蛋白標記物的比較
| 蛋白標記物 | 優點 | 缺點 |
|---|---|---|
| 未染色標記 | 無染色標記物是最準確的蛋白質標記物,它不攜帶染色分子或標記分子,能準確測定蛋白質大小。 | 電泳過程中看不到未染色的標記物,電泳和轉移過程無法實時監控。它必須被弄臟才能被看見。; |
| 預染色標記物 | 預染色標記物是蛋白質與染料共價偶聯的混合物,在實驗過程中可以用肉眼直接觀察到,并在電泳和轉移過程中作為參考。 | 由于染料偶聯,改變了電泳染色后蛋白質分子的遷移效率,導致指示分子量的偏移,從而導致蛋白質上漿不準確。 最終結果需要在標記和目標波段之間進行比較,在此過程中可能會出現人為錯誤。 |
| 暴露標記 | 靶帶和標記帶可以同時暴露,以減少錯誤和蛋白質的流動性。 | 高成本 |
這解釋了為什么在免疫印跡中觀察到的帶狀大小與預測的大小不同。為了盡量減少預染色標記物引起的分子量偏移的影響,可以將其與未染色標記物進行對比,以確定目標帶的準確分子量大小(下圖左側顯示了預染色標記物和未染色標記物之間的差異)。此外,不同廠家的蛋白質標記物差異很大,客戶在選擇蛋白質標記物時應謹慎(下圖右側顯示了不同廠家的預染色標記物之間的差異)。在確定免疫印跡結果中的蛋白質時,應考慮到預染色標記物引起的分子量偏移。
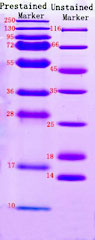
染色maker和未染色marker
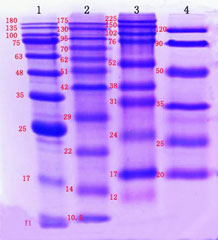
來自不同制造商的染色標記
陽性對照:可以使用表達感興趣蛋白質的細胞系組織或細胞裂解液作為陽性對照。
負載對照:在各種組織和細胞中,由 housekeeping 基因編碼的蛋白質水平相對恒定,這種蛋白質可以在定量感興趣蛋白質時作為負載對照,以確保每條凝膠槽中加載相同數量的蛋白質。此外,負載對照蛋白質還可用于評估實驗是否運行成功。
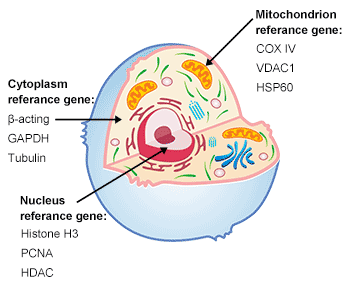
圖3. 細胞的結構
常見的內部參考基因(housekeeping gene):根據實驗的目的,在研究不同蛋白質時選擇正確的負載對照蛋白質非常重要。
選擇負載對照蛋白質時應考慮以下因素:
表10. 基因在細胞的不同位置
| Nuclear | Nuclear membrane | Cytoplasm | Cellular membrane | Mitochondrion | Membrane | |
|---|---|---|---|---|---|---|
| 動物組織/細胞 | 組蛋白H3 (17 kDa), PCNA (29 kDa)) | Lamin B (66 kDa) | β-actin (43 kDa), GAPDH (36 kDa), Tubulin (5 kDa) | Na+/K+-ATP ase (120 kDa) | CoX IV(17 kDa), VDAC1 (30 kDa) | ATP1A1 (113 kDa) |
a. 某些常規基因的表達水平可能會受到某些實驗條件的影響,如外界刺激或藥物處理。在選擇負載對照蛋白質時,重要的是參考相關文獻并驗證其在樣本中的表達是否恒定,且不受某些實驗條件的影響。
b. 感興趣蛋白質的分子量應與負載對照蛋白質的分子量有所區別,以便進行清晰的檢測和區分。如果負載對照蛋白質與感興趣蛋白質具有相似的分子量,在可視化感興趣蛋白質的帶狀條之后,使用主/次抗體去除液洗去抗體,然后再進行負載對照抗體的孵育和負載對照蛋白質的可視化。
4.4 凝膠電泳
a. 快速離心樣品以去除雜質,建議將10-30 μg總蛋白質加載到凝膠槽中。純化蛋白質的推薦負載量為10-100 ng。根據結果需要調整負載量。
b. 在一個槽中加入分子量標記物以指示感興趣蛋白質。
c. 使用恒定電壓進行電泳(電壓設定為120 V或更低)。為了獲得更好的實驗結果,在全蛋白質在濃縮凝膠中遷移時,建議使用80 V。當蛋白質遷移到分離凝膠時,應提高電壓。
d. 通常的電泳時間約為1.2小時。然而,分子量小于20 kDa的蛋白質應根據感興趣的蛋白質縮短電泳時間。而大于100 kDa的蛋白質,應延長電泳時間以獲得更好的蛋白質分離效果。
5. 轉印
5.1 轉印方法
將分離的蛋白質從凝膠轉移到固相介質,通常使用濕式轉印和半干式轉印方法。這兩種轉印方法在原理上是相同的,只是施加電場的機械裝置和固定凝膠和膜的方法不同,半干式轉印使用浸潤有緩沖溶液的多層濾紙。
表11. 轉移方式類型的比較
| 方法 | 方法 | 缺點 |
|---|---|---|
| 槽式轉印 | 膜轉印效果好,轉印時溫度可控。 | 需要較長的時間,并且需要大量的傳輸緩沖區。 |
| 半干式轉印 | 膜傳輸效率高,時間短,傳輸緩沖液消耗少。 | 在膜轉移過程中,溫度無法控制,最終導致高本底溫度。 |
在轉印膜時,高電流下裝置在短時間內會迅速產生熱量。因此,在轉印膜時需要采取措施保持低溫條件。在槽式轉印中,可以用冰水浸泡裝置進行散熱,而在半干式轉印中,不適宜進行長時間的電流通,因此我們建議在高分子量蛋白質(100 kDa以上)的情況下使用槽式轉印。
對于低分子量和中分子量蛋白質,半干式轉印和槽式轉印的效果幾乎相同。
5.2 膜的選擇
硝酸纖維素(NC)和聚偏氟乙烯(PVDF)是最常用的轉印膜。
表12. NC膜與PVDF膜的比較
| NC膜 | PVDF膜 | |
|---|---|---|
| 蛋白結合量 | 80-100 μg/cm2 | 100-300 μg/cm2 |
| 結合強度 | 低 | 高 |
| 物理特性 | 易碎 | 耐用且有彈性 |
| 是否需要激活 | 無需激活 | 酒精激活 |
膜的結合能力主要與其純度有關,純度越高,蛋白質的結合能力就越強。然而,高純度的硝酸纖維素膜易碎且容易破裂。與硝酸纖維素膜相比,聚偏氟乙烯(PVDF)膜不僅具有更強的蛋白質結合能力,還具有更好的化學抗性。
請注意,在使用聚偏氟乙烯膜之前,應用甲醇浸泡(>15秒)激活膜上的正電荷基團,并在膜緩沖液中平衡一段時間。此外,PVDF膜和硝酸纖維素膜具有不同的孔徑。
對于小分子蛋白質(<20 kDa),我們建議采用0.22 μm的孔徑膜,以避免超過轉移的限制。
對于大多數情況,建議使用0.45 μm的孔徑膜。
5.3 蛋白質分離和膜轉印條件優化
● 關于小分子蛋白質的膜轉印,我們可以基于以下幾個方面進行優化:
a. 增加交聯劑的濃度,并使用15%丙烯酰胺凝膠進行電泳。然而,針對15 kDa以下的蛋白質,15%丙烯酰胺凝膠的分辨率較低,因此我們建議在堆積凝膠和分離凝膠之間添加10%的中間層凝膠,以增加小分子蛋白質的分辨率。
b. 將Tris-Glycine緩沖系統替換為Tris-Tricine電泳系統,以獲得更好的濃縮和分離效果。請注意,在使用Tris-Tricine時,電壓應適中,60 V-80 V為宜。
c. 選擇0.22 μm的孔徑膜。
d. 縮短膜轉印時間。
● 關于大分子蛋白質的膜轉印,我們可以基于以下幾個方面進行優化:
a. 降低交聯劑的濃度,使用8%-5%丙烯酰胺凝膠進行電泳。請注意,凝膠濃度越低,膜越脆弱,請在操作時小心處理。
b. 在轉印過程中,適當提高電流,延長膜轉印時間,避免產生熱量。建議在4℃溫度下進行長時間(過夜)的槽式轉印。
c. 減少轉印緩沖液中的甲醇含量有助于將SDS分子與蛋白質分離。高濃度甲醇固定蛋白質對大分子蛋白質不利,建議將甲醇濃度降低到10%。
5.4 轉印效率監測
a. 預染標記物的轉印結果反映了蛋白質的轉印效率。
b. 使用朋酮染色劑染色,從染色的帶狀條判斷轉印是否成功。這個過程是可逆的,但不適用于尼龍膜。
朋酮染色溶液制備:將5%(體積/體積)乙酸,0.1%(質量/體積)朋酮溶解在純水中,存放在4℃。
朋酮染色過程:
- 將轉印后的PVDF或NC膜浸泡在朋酮染色溶液中,搖擺5-10分鐘。
- 取出膜,用PBS洗滌3次×5分鐘。
- 觀察染色的紅色條帶并記錄轉印結果。
- 再次用PBS洗滌3次×5分鐘以去除結合的朋酮,以便進行進一步的Western blot分析。
c. 使用柯曼藍染色溶液染色,這個過程是不可逆的,但柯曼藍染色溶液的靈敏度高于朋酮染色溶液。
柯曼藍染色溶液制備:加入10%(體積/體積)冰醋酸、45%(體積/體積)甲醇、0.25%(質量/體積)柯曼藍,純水混合均勻。
柯曼藍染色去染溶液制備:加入25%(體積/體積)甲醇、8%(體積/體積)冰醋酸,純水混合均勻。
柯曼藍染色過程:
- 將轉印后的PVDF和NC膜浸泡在柯曼藍染色溶液中,用搖床在室溫下緩慢搖動1小時(根據凝膠的尺寸、厚度和溫度進行適當調整),直到凝膠變藍。
- 倒掉染色溶液,將凝膠浸泡在去染溶液中,在室溫下用搖床緩慢搖動4小時,直到藍色背景去染,蛋白質條帶可見。
5.5 轉印緩沖液的制備
制備1L轉印緩沖液如下:
表13. 1L傳輸緩沖器的組件
| 試劑 | 質量(g) |
|---|---|
| Glycine | 11.26 |
| Tris | 2.43 |
| Methanol | 200 mL |
| *加入ddH2O,充分溶解 | |
轉印緩沖液需要避光儲存,可以重復使用。
然而,由于甲醇具有揮發性,需要及時更換新鮮的轉印緩沖液。
5.6 轉印
a. 小心分離分離凝膠。
b. 使用濾紙-凝膠-濾紙制作“三明治”,保持“三明治”濕潤并避免氣泡。制備“三明治”的步驟如下:
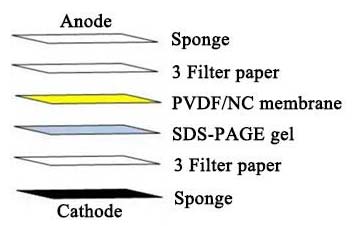
c. 根據制造商的說明書組裝轉印裝置。將蛋白質轉移到硝酸纖維素或PVDF膜上。對于分子量低于20 kDa的蛋白質,推薦使用0.22 μm的膜。
d. 根據實際情況,通常有兩種選擇的轉印裝置,濕式轉印和半干式轉印。濕式轉印和半干式轉印對于常規大小的蛋白質(20-100 kDa)都可以很好地工作,但由于半干式轉印可能產生更高的背景染色,濕式轉印更適用于高分子量蛋白質。
e. 用PBS緩沖液沖洗印跡約5分鐘。
6. 阻斷
使用阻斷緩沖液在室溫下阻斷膜1小時。
選擇阻斷緩沖液
結合表面不平整,有許多小孔。當蛋白質被轉移到結合表面時,通過相互作用吸附到結合表面。然而,并不是所有的位點都被蛋白質吸附,因此需要阻斷緩沖液吸附到剩余的結合位點,以防止抗體分子直接吸附到膜上導致偽陽性或高背景結果。
選擇阻斷緩沖液的原則應該是:
a. 阻斷緩沖液能夠阻斷結合膜上所有未結合的位點。
b. 阻斷緩沖液不干擾目標蛋白質的結合。它不與目標蛋白質的表位結合,也不與其他試劑發生交叉反應。
以下是常用阻斷緩沖液的具體細節:
表14. 各種阻塞緩沖區的比較
| 阻斷緩沖液 | 優點 | 缺點 |
|---|---|---|
| 5%脫脂奶粉 | 該成分復雜,含有許多不同分子量的蛋白質,具有充分的阻斷作用。 | 不適合生物素-親和素和堿性磷酸酶檢測系統(由于脫脂奶粉中存在少量生物素和堿性磷酸酶殘留) |
| 1% 酪蛋白 | 它在中性和堿性條件下帶負電荷,并與帶正電荷的膜相互作用。 | 溶解度相對較差,不利于堵塞。 |
| 5% BSA | 該組件很簡單,它與大多數情況兼容。 | 當免疫原與BSA偶聯時,由于其具有一定的免疫原性,可能與抗體中殘留的BSA發生交叉反應,產生一定的背景。 |
| 血清 | 不僅可以阻斷非特異性結合,血清中的抗體還可以阻斷樣品中可能存在的FC受體,以避免一抗和二抗對FC受體發生反應。 | 成本相對較高。 |
| 非蛋白質化合物 | 明膠、吐溫-20等可減少蛋白質間的疏水相互作用,洗脫非特異性吸附,提高抗體的特異性識別能力。 |
不同阻塞緩沖區的對比實驗如下:
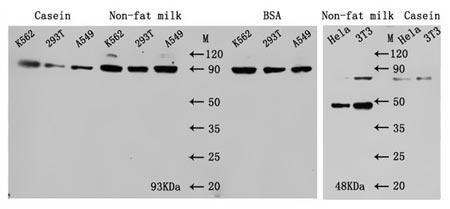
圖4. 不同阻塞緩沖區的比較
7. 一抗孵育
按照產品說明書稀釋一抗,通常一抗稀釋緩沖液的成分與阻斷緩沖液相同。此外,我們建議選擇經過驗證的一抗,并將一抗在4℃下孵育過夜,以確保抗原和抗體充分結合。
我們建議進行梯度初步實驗來確定一抗的最佳稀釋比例,例如點印法。
a. 依次將不同加載量的樣品加載到NC膜上,自然風干。
b. 樣品完全吸附后,阻斷膜。
c. 根據加載梯度切割膜。
d. 分別使用不同濃度梯度的一抗和二抗孵育。
e. 最后,采用ECL發光底物孵育和顯影,根據顯影結果初步確定稀釋比例范圍。
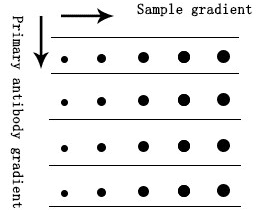
圖5. Dot Blot
8. 二抗孵育
8.1 實驗操作
a. 在二抗孵育前,用PBST/TBST洗滌膜3次,每次10分鐘,以去除未結合的一抗。
b. 適當稀釋二抗,在室溫下孵育1小時。
c. 二抗孵育結束后,用PBST/TBST洗滌膜3次,每次10分鐘,以去除未結合的二抗。
8.2 二抗選擇
● 物種來源
我們不建議選擇兔、大鼠或小鼠物種的二抗,因為它們與人類物種的同源性較高,容易發生交叉反應,從而導致高背景。常用的二抗物種來源是山羊或驢,但請注意,所選二抗的物種來源必須與所選一抗的物種來源不同,二抗的物種來源選擇取決于一抗的物種。
此外,如果使用的是單克隆一抗,則還需要注意亞型,并選擇針對一抗亞型的二抗。
● 純化方法
主要的純化方法有蛋白G/A純化和抗原親和純化。
蛋白G/A純化方法結合了血清中所有抗體IgG分子,沒有抗原特異性區分。
親和純化是一種通過與抗體特異識別的配體或受體結合來洗脫的方法。通過這種方法可以純化血清中的特定抗體成分。因此,具有抗原親和純化方法的二抗會降低非特異性結合并提高檢測蛋白的特異性。
● 適合的共軛
在Western Blot驗證中,最常用的二抗共軛是辣根過氧化物酶(HRP)共軛,如辣根過氧化物酶(HRP)和堿性磷酸酶(AP)。
常用作底物的HRP具有高特異性、穩定、快速和經濟的特點。雖然AP更為敏感,但背景通常較高,并且可能存在于實驗樣品中的內源性磷酸酶可能對結果產生干擾。
此外,如果使用AP共軛的二抗,請注意選擇合適的阻斷緩沖液,以避免磷酸酶的干擾。
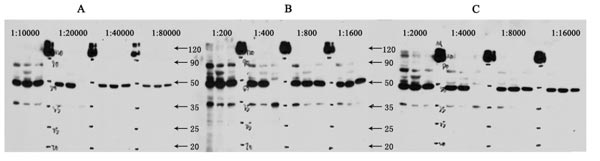
圖6. 稀釋范圍根據不同制造商的說明
9. 圖像顯現
● 化學發光顯現
Luminol是最經典的辣根過氧化物酶(HRP)化學發光底物之一,在H2O2存在下與辣根過氧化物酶發生酶催化反應,具有高靈敏度和良好的成像特性,可以在膠片上顯現。
● 底物顯現
有許多種HRP染色底物,最常用的是DAB。它通過與HRP反應形成不溶性棕色沉淀物來顯現,同時具有高靈敏度。
然而,它需要在點滴上使用,并且具有致癌性,請在操作時注意安全。
● 熒光顯現
通過使用適當的熒光二抗,可以實現熒光二抗顯現,彌補了化學發光和底物顯現在定量上的不足。
10. 常見問題
10.1 背景高
| 可能原因 | 解決方案 |
|---|---|
| 阻塞緩沖區不足或不適當 | 優化阻塞效果,選擇正確的阻塞緩沖區 |
| 抗體孵育濃度過高、孵育時間過長或溫度過高 | 調整抗體孵育濃度和孵育時間 |
| 清洗不足 | 增加洗滌次數,延長洗滌時間 |
| 二抗非特異性結合 | 設置二抗的控制項,選擇合適的二抗 |
| 膜干燥 | 操作時保持膜濕潤 |
| 膜被污染 | 操作時保持膜的清潔,不要用手按壓 |
| 過量的化學發光底物殘留物 | 瀝干多余的化學發光液體,然后顯影 |
| 膠片曝光時間太長 | 多次檢查以確定最佳曝光時間 |
10.2 無目標波段
| 可能原因 | 解決方案 |
|---|---|
| 樣品中的靶蛋白豐度較低,或根本不表達 | 再次確認檢測樣品的可行性,在檢測前富集目標蛋白的豐度。 |
| 提取過程中蛋白質的降解 | 在蛋白提取過程中,低溫保存蛋白,加入蛋白酶抑制劑 |
| 蛋白質樣品的儲存條件不正確,導致蛋白質降解。 | 建議將蛋白質樣品用SDS熱變性后保存。有價值的樣品建議保存在-80℃。 |
| 蛋白質轉移效率低 | 采用Ponceau確認傳輸系統是否正常。 |
| 抗體孵育濃度過低,或孵育時間過短 | 優化抗體孵育量,一抗推薦4℃孵育過夜 |
| 一抗和二抗不相容 | 選擇正確的一抗和二抗 |
| 抗體滅活了 | 妥善儲存抗體 |
| 顯影液可能過期了 | 使用新鮮的顯影液,并防止光線照射。 |
10.3 觀測波段大小與預測波段大小不匹配
| 可能原因 | 解決方案 |
|---|---|
| 標記器顯示的尺寸有偏差 | 選擇合適的預漬標記,觀察與未預漬標記的區別 |
| 電泳系統的影響 | 為避免邊緣孔的不穩定因素,將樣品裝入中間孔,并在邊緣孔電泳平衡系統中加入等量的上樣緩沖液。 |
| 翻譯后修飾 | 通過查閱文獻來確認蛋白質是磷酸化還是糖基化,等等。 |
| 翻譯后剪切和異構體。 | 查閱文獻,看看這種蛋白質是否有多種剪接活性形式。 |
| 蛋白質聚合物的形成 | 在樣品制備過程中,使用新鮮的DTT或β-巰基乙醇保持蛋白質單體狀態。 |
| 蛋白質電荷的相對變化 | 蛋白質的氨基酸組成不同,部分蛋白質的電荷沒有完全被帶負電荷的SDS覆蓋,導致蛋白質遷移速率與蛋白質大小不成正比。 |
10.4 其他問題
| 可能原因 | 解決方案 |
|---|---|
| 膜上可見反射或黃色帶 | 一抗或二抗濃度過高,或上樣量過多,導致酶被瞬間消耗 |
| 白色空白點 | 跨膜夾層中有氣泡殘留,或抗體孵育不均勻,應振蕩孵育。 |
| 背景上的黑點 | 阻斷緩沖殘留物的顆粒,使用前請充分攪拌溶解 |
| “微笑”條帶 | 遷移速度過快,運行凝膠時降低電壓。 凝膠凝固不均勻,應正確配制。 |
| “皺眉”帶 | 電泳時,襯底可能聚集大量氣泡,容易導致電壓不平衡,最終形成“皺眉”帶 。 |
| 涂抹帶 | 樣品中含有不溶物,建議離心或優化蛋白質提取。 樣品超載,請減少每條通道的蛋白質負荷。 凝膠的濃度不合適,蛋白質的分辨率低。我們建議調整交聯劑的比例。 電泳緩沖液可能重復使用,請更換新鮮的電泳緩沖液。 |
| 畸變帶 | 凝膠表面不均勻或制備不均勻。 樣品中鹽離子濃度過高,影響了電泳。 電壓過高,導致遷移快。 |






