“顫抖的”帕金森病
帕金森病(PD)最初由英國醫生詹姆斯·帕金森在1817年的《關于震顫麻痹的論文》中描述,他描述了六位患有一種以消瘦和震顫為特征的神經系統障礙的患者 [1]。七十年后,法國神經學家讓-馬丁·沙可首次對這種疾病進行了臨床描述,并以詹姆斯·帕金森的名字命名,以表彰其貢獻。
1. 什么是帕金森病?
帕金森病(PD)是一種慢性、進展性的神經系統疾病,已成為全球第二常見的神經退行性疾病,影響65歲以上人口的1% [2]。
帕金森病主要分為散發性和家族性兩種形式。大多數(90-95%)患者患有散發性PD,也稱為特發性PD(IPD),這是由個體遺傳構成與環境因素之間復雜的相互作用決定的。家族性病例,由遺傳突變的孟德爾遺傳導致,約占帕金森病患者的5-10%。攜帶與PD相關基因的個體有更高的PD風險。
2. 帕金森病的癥狀有哪些?
帕金森病的癥狀通常逐漸開始,最初較輕。與該疾病相關的有多種癥狀,但其進展和嚴重程度在個體間有所不同。帕金森病患者很少遇到所有或大多數這些癥狀。
2.1 帕金森病的運動癥狀
帕金森病的核心運動癥狀包括肌強直和震顫、肌僵直、運動遲緩、姿勢不穩和行走或步態困難。
- 震顫,手、臂、腿和頜部的顫抖。
- 肌強直,四肢或軀干的緊張或僵硬。
- 運動遲緩,動作緩慢,面部表情減少或面具臉,眨眼頻率減少,平衡和協調能力受損。
- 姿勢不穩,平衡問題。
- 行走或步態困難,如猶豫、過渡和運動開始時的凍結步態。
- 言語問題,聲音低沉或聲音變軟,可能開始時很強然后逐漸消失,可能失去聲音的常態量和情感變化;在晚期,言語可能會加快,導致單詞擁擠,可能出現口吃。
2.2 帕金森病的非運動癥狀
- 認知障礙
- 早飽
- 自主功能障礙,如便秘和直立性低血壓
- 疲勞 [3]
- 幻覺 [4]和妄想
- 神經精神障礙,如抑郁、焦慮、冷漠、易怒和睡眠障礙
- 感覺癥狀,嗅覺功能障礙
- 泌尿系統問題(緊急、頻繁、失禁)
- 性問題,如勃起功能障礙
- 視力問題
- 體重減輕

圖1. 帕金森病的癥狀
除了運動癥狀外,PD患者通常還必須應對相關的非運動癥狀。這強調了PD不僅僅是中樞神經系統的疾病,而是一種系統性疾病。
3. 帕金森病的原因是什么?
帕金森病的原因尚不完全清楚,但大量研究表明,帕金森病的病理是黑質(SN)多巴胺能神經元的退化和含有α-突觸核蛋白(α-syn)聚集體的Lewy體的存在 [5-7]。α-突觸核蛋白的聚集和積累使神經元退化持續下去。
研究還表明,帕金森病的病因與多種因素有關,包括遺傳易感性、環境因素、衰老等。
3.1 遺傳因素
至少5%的PD病例與多個基因的突變有關,包括富含亮氨酸的重復激酶2(LRRK2)、α-突觸核蛋白(SNCA)、β-葡萄糖苷酶1(GBA1)、磷酸酶和張力蛋白同源物誘導激酶1(PINK1)、帕金(PRKN)和PARK7(DJ-1)[8-10]。這些基因與家族性PD的高風險有關。
這些突變基因的產物導致細胞內運輸異常、氧化應激、線粒體功能障礙、蛋白質質量控制中斷、蛋白質錯誤折疊和聚集、泛素-蛋白酶系統功能障礙以及激酶活性改變,在PD的發病機制中起著關鍵作用。某些突變還可能導致PD的早期發病。
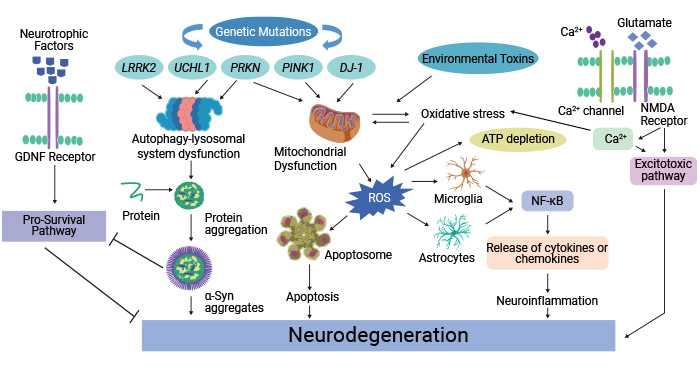
圖2. 帕金森病病理生理中涉及的分子機制
這張圖片引用自:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC8962417/
| PARK基因座 | 基因/蛋白 | 遺傳方式 | 生理功能 |
|---|---|---|---|
| PARK1/4 | SNCA/α‐synuclein | Autosomal dominant (AD) | 囊泡介導的內吞作用 神經遞質釋放 外泌體釋放 分子伴侶介導的自噬 α-突觸核蛋白聚集和累積是Lewy體的主要成分,導致神經元退化 |
| PARK5 (putative) | UCHL1 | AD | 泛素C末端水解酶L1:處理泛素化蛋白和泛素前體 |
| PARK8 | DARDARIN/LRRK2 | AD | 囊泡介導的內吞作用 自噬 神經遞質釋放 內溶酶體運輸 外泌體釋放 單基因致病突變可能降低GTP酶活性或增加激酶活性 |
| PARK11(putative) | GIGYF2 | AD | GRB10相互作用的GYF蛋白2:抑制翻譯啟動 |
| PARK13(putative) | HTRA2 | HtrA絲氨酸肽酶2:蛋白水解活性,促進細胞凋亡 | |
| PARK17 | VPS35 | AD | 自噬 內溶酶體運輸 高爾基體復合體運輸 VPS35突變導致逆行體功能障礙、蛋白聚集、線粒體功能障礙、多巴胺信號傳導受阻、質膜受體循環和囊泡運輸受阻[11] |
| PARK18 | EIF4G1 | AD | 控制編碼線粒體、細胞存活和生長蛋白的mRNAs的翻譯啟動 |
| PARK21 | DNAJC13/RME‐8 | AD | 囊泡介導的內吞作用 內體排序/運輸 致病性DNAJC13突變導致異常的內體α-突觸核蛋白滯留 |
| PARK22 | CHCHD2 | AD | 涉及線粒體呼吸鏈復合體;CHCHD2的T61I突變導致自主顯性PD形式 |
| PARK2 | PRKN/Parkin | Autosomal recessive (AR) | 囊泡介導的內吞作用 線粒體質量控制、神經遞質釋放 泛素化、調節線粒體自噬降解 |
| PARK6 | PINK1 | AR | 線粒體質量控制(線粒體自噬、融合和分裂、線粒體衍生囊泡) |
| PARK7 | PARK7/DJ‐1 | AR | 線粒體功能 線粒體活性氧的轉錄調控 |
| PARK9 | ATP13A2 | AR | 內溶酶體通路 外泌體釋放 與早發性PD相關的Kufor-Rakeb綜合征(KRS);ATP13A2突變導致溶酶體功能障礙,引起α-突觸核蛋白異常堆積[12] |
| PARK14 | PLA2G6 | AR | 膜運輸 磷脂代謝 線粒體功能 |
| PARK15 | FBX07 | AR | 泛素化和蛋白酶體降解、增殖 |
| PARK19 | DNAJC6/Auxilin | AR | 囊泡介導的內吞作用 高爾基體-溶酶體運輸 |
| PARK20 | SYNJ1/Synaptojanin 1 | AR | 囊泡介導的內吞作用 突觸自噬 |
| PARK23 | VPS13C | AR | 涉及線粒體生物發生和線粒體自噬的脂質轉運蛋白 |
表信息來源:https://www.ncbi.nlm.nih.gov/pmc/articles/PMC6138432/ 和 https://www.ncbi.nlm.nih.gov/pmc/articles/PMC10308076/
3.2 環境因素
- 神經系統問題:核上性麻痹、威爾遜病、亨廷頓病、哈勒·瓦爾登-施帕茨綜合征和阿爾茨海默病也可能導致帕金森病。
- 腦損傷:導致意識水平變化的創傷性腦損傷,增加了受傷后幾年患PD的風險 [13]。
- 居住地區:PD的地理分布存在差異,這可能是由于環境和遺傳因素的差異所致。
- 職業:某些職業類別或職位與PD的高發病率有關。工作壓力增加患帕金森病的風險。
- 農藥暴露:農藥(包括賽克寧和六氯環己烷)在與帕金森病相關的所有化學物質暴露中報告最為一致。
- 接觸金屬:職業性接觸各種金屬被認為與PD的發展有關。
3.3 衰老
年齡是患帕金森病的最大風險因素,60歲以后發病率顯著增加,在隨后的幾十年中呈指數增長。帕金森病主要影響老年人,尤其是55至65歲之間的人群,65歲以上人群中有1%,85歲以上人群中有5%或更多的人受影響 [14]。
早發性帕金森病(YOPD)發生在50歲以下的人群中。在極少數情況下,兒童和青少年可能出現類似帕金森病的癥狀。被診斷為YOPD的人有更頻繁的帕金森病家族史和更長的生存期。
4. 關于帕金森病的數據和事實
4.1 數據
流行病學顯示,患病率為15~328/10萬,大約1%的65歲以上人群。每年的發病率是10到21/10萬人口。在美國,發病率是每10萬人中21例 [15]。鑒于全球預期壽命的增加,預計到2030年,受帕金森病影響的人數以及隨之而來的個人、社會和經濟負擔將急劇增加 [16]。到2020年,美國將有近100萬人患有帕金森病,每年約有6萬名美國人被診斷出帕金森病。全球有超過1000萬人患有帕金森病。
4.2 事實
年齡:帕金森病主要發生在老年人中,盡管年輕人也可能患上帕金森病,但估計只有4%的帕金森病患者在50歲之前被診斷。帕金森病的平均發病年齡是60歲,PD的患病率隨年齡增長而增加。
性別:男性比女性患帕金森病的可能性高1.5倍。有帕金森病父母或兄弟姐妹的人可能因遺傳突變而使患帕金森病的風險加倍。
種族:患病率存在種族差異,白人最高,其次是黃種人,黑人最低。
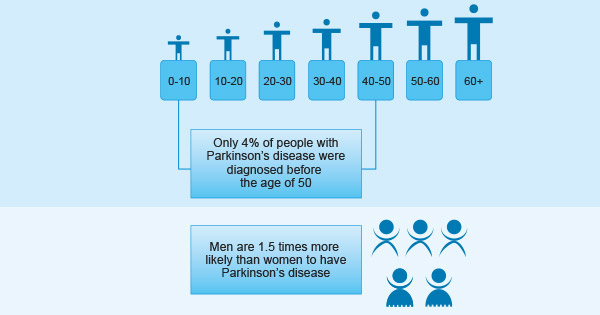
圖3. 帕金森病的事實
4.3 帕金森病的案例
當名人公開他們的疾病時,這有助于提高人們對疾病的認知,增加他們對疾病的了解。
穆罕默德·阿里(1984年診斷)在離開拳擊運動三年后被診斷出患有帕金森病。他在全球范圍內提高了人們對帕金森病的認識,并幫助在亞利桑那州鳳凰城建立了穆罕默德·阿里帕金森中心。
邁克爾·J·福克斯(1991年診斷)是世界上最著名的帕金森病患者之一。他致力于帕金森病研究的進一步發展,并建立了邁克爾·J·福克斯帕金森病研究基金會。
布賴恩·格蘭特(2008年被診斷出患有帕金森病)并成立了布賴恩·格蘭特基金會,以幫助其他人做同樣的事情。
此外,喬治·H·布什、比利·康諾利、艾倫·阿達、尼爾·戴蒙德和帕特·托爾皮也被診斷出患有帕金森病。
5. 分子通路在帕金森病病理生理中的作用
盡管帕金森病的確切原因尚未完全理解,但有幾個分子通路和過程被認為在這種疾病的發展和進展中起著作用。了解這些通路對于開發旨在減緩或停止帕金森病進展的靶向治療至關重要。
5.1 多巴胺系統功能障礙
病理上,PD主要表現為黑質致密部(SNPC)投射到紋狀體的多巴胺能神經元的減少,沿黑質紋狀體通路。黑質紋狀體通路是一個重要的多巴胺能通路,負責調節自愿運動和運動功能。
這種神經退行性導致紋狀體中多巴胺水平顯著降低,這增加了基底神經節中的整體興奮性驅動,阻斷了自愿運動控制并引起帕金森病特有的運動障礙[17]。當多巴胺能神經元損失高達50%至80%時,患者通常開始表現出帕金森病的運動癥狀。
5.2 α-突觸核蛋白聚集
α-突觸核蛋白是一種由140個氨基酸組成的突觸前蛋白,具有多種構象,并以多種寡聚態存在,維持著動態平衡。突變的α-突觸核蛋白會經歷構象變化,使其易于形成聚集體和Lewy體。α-突觸核蛋白的聚集被認為具有神經毒性,并促成了黑質中多巴胺能神經元的進行性退化。這種神經退行性導致了帕金森病的特征性運動癥狀。
5.3 線粒體功能障礙
與PD相關的線粒體功能障礙基因包括SNCA、LRRK2、VPS35、CHCHD2、PARK、PINK1、DJ-1、ATP13A2、PLA2G6和FBXO7的突變。PINK1和Parkin突變與線粒體自噬有關,可能導致缺陷線粒體的積累并促成功能障礙。
PD中的線粒體功能障礙導致能量產生缺陷(特別是在多巴胺能神經元中)、增加的氧化應激、線粒體DNA損傷、細胞凋亡、改變的鈣穩態、受損的線粒體自噬、α-突觸核蛋白積累,以及整體細胞功能障礙。所有這些最終加速了多巴胺能神經元的退化和死亡。
5.4 氧化應激
氧化應激是PD發病機制中的關鍵因素。在PD中,這種氧化損傷對黑質中的多巴胺能神經元尤為有害。線粒體功能障礙、α-突觸核蛋白聚集和炎癥促成了PD中活性氧(ROS)的增加產生。氧化應激可以進一步加劇線粒體損傷,觸發細胞凋亡途徑,并促進α-突觸核蛋白的錯誤折疊。
5.5 炎癥和免疫反應
神經炎癥是恢復正常大腦結構和功能的保護機制。然而,當過度激活時,神經炎癥成為神經退行性變的重要驅動因素。慢性神經炎癥是PD病理學中一個關鍵的標志。
神經炎癥的特征是大腦中的免疫細胞如小膠質細胞和星形膠質細胞的激活。免疫反應是由α-突觸核蛋白聚集、線粒體功能障礙和氧化應激等因素觸發的。激活的小膠質細胞釋放炎癥介質,促成受影響區域(尤其是黑質)的慢性炎癥環境。這種持續的免疫反應可以加劇神經元損傷,并促進PD的進展。
5.6 自噬功能障礙
自噬在清除錯誤折疊的蛋白(特別是α-突觸核蛋白,其聚集是PD病理的標志)中起著至關重要的作用。神經元,特別是PD中受影響的多巴胺能神經元,嚴重依賴有效的自噬來維持細胞穩態。自噬功能障礙可能損害神經元健康,并促成PD中觀察到的進行性退化。
與自噬相關的基因突變,如PINK1和Parkin,已與家族性PD形式相關聯。這些基因對于維持正常的自噬功能至關重要。自噬依賴于溶酶體來降解吞噬的細胞物質。溶酶體途徑的功能障礙可以損害自噬過程,并促成PD中有毒蛋白聚集的積累。
總結來說,PD是一種進展性的神經退行性疾病,病理特征是黑質致密部多巴胺能神經元的喪失和含有α-突觸核蛋白的Lewy體的形成。多種因素共同促成了PD的發展,包括形成Lewy體的α-突觸核蛋白聚集、線粒體功能障礙、神經炎癥,以及興奮毒性和金屬積累。
目前對帕金森病的研究強調了遺傳和環境因素之間的相互作用、PD病理從外周向中樞神經系統的傳播,以及對神經炎癥和多巴胺神經元退化分子機制的深入探索。
參考文獻:
[1] Parkinson T. Outlines of Zoonosological Tables. Lond. Med. Phys. J. 1817;38:449–453.
[2] Tysnes, O.-B.; Storstein, A. Epidemiology of Parkinson's Disease [J]. J. Neural Transm. 2017, 124, 901–905.
[3] Siciliano Mattia, Trojano Luigi, Santangelo Gabriella. et al. Fatigue in Parkinson's disease: A systematic review and meta-analysis [J]. Mov. Disord, 2018, undefined: undefined.
[4] Swann Peter, O'Brien John T. Management of visual hallucinations in dementia and Parkinson's disease [J]. Int Psychogeriatr, 2018, undefined: 1-22.
[5] Trist B., Hare D., Double K. (2019). Oxidative stress in the aging substantia nigra and the etiology of Parkinson's disease [J]. Aging cell 18:e13031.
[6] Alvarez-Erviti L., Seow Y., et al. (2011). Lysosomal dysfunction increases exosome-mediated alpha-synuclein release and transmission [J]. Neurobiol. Dis. 42 360–367. 10.1016/j.nbd.2011.01.029.
[7] Roberts R., Wade-Martins R., Alegre-Abarrategui J. (2015). Direct visualization of alpha-synuclein oligomers reveals previously undetected pathology in Parkinson's disease brain [J]. Brain 138 1642–1657.
[8] Kim J., Daadi E.W., Oh T., Daadi E.S., Daadi M.M. Human Induced Pluripotent Stem Cell Phenotyping and Preclinical Modeling of Familial Parkinson's Disease [J]. Genes. 2022;13:1937.
[9] Verstraeten A., Theuns J., Van Broeckhoven C. Progress in unraveling the genetic etiology of Parkinson disease in a genomic era [J]. Trends Genet. 2015;31:140–149.
[10] Kalinderi K., Bostantjopoulou S., Fidani L. The genetic background of Parkinson's disease: Current progress and future prospects [J]. Acta Neurol. Scand. 2016;134:314–326.
[11] Rahman AA, Morrison BE. Contributions of VPS35 Mutations to Parkinson's Disease [J]. Neuroscience. 2019 Mar 1;401:1-10.
[12] Zhang F, Wu Z, Long F, et al. The Roles of ATP13A2 Gene Mutations Leading to Abnormal Aggregation of α-Synuclein in Parkinson's Disease. Front Cell Neurosci. 2022 Jul 6;16:927682.
[13] Gardner Raquel C, Byers Amy L, Barnes Deborah E, et al. Mild TBI and risk of Parkinson disease: A Chronic Effects of Neurotrauma Consortium Study [J] .Neurology, 2018, 90: e1771-e1779.
[14] Pringsheim T, Jette N, Frolkis A, et al. The prevalence of Parkinson's disease: a systematic review and meta-analysis [J]. Movement Disorders Official Journal of the Movement Disorder Society, 2015, 29(13):1583-1590.
[15] Savica R, Grossardt BR, Bower JH, et al. Incidence and pathology of synucleinopathies and tauopathies related to parkinsonism [J]. JAMA Neurol, 2013, 70:859-66.
[16] Dorsey ER, Constantinescu R, Thompson JP, et al. Projected number of people with Parkinson disease in the most populous nations, 2005 through 2030 [J]. Neurology, 2007; 68:384-6.
[17] Gordián-Vélez WJ, Chouhan D, et al. Restoring lost nigrostriatal fibers in Parkinson's disease based on clinically-inspired design criteria [J]. Brain Res Bull. 2021 Oct;175:168-185.






