MICB:連接細(xì)胞應(yīng)激與免疫應(yīng)答的關(guān)鍵分子
日期:2025-06-25 13:13:13
1. MICB的背景
1.1 分子結(jié)構(gòu)與定位
主要組織相容性復(fù)合體I類鏈相關(guān)蛋白B(Major Histocompatibility Complex Class I Chain-Related Protein B,MICB)位于人類6號(hào)染色體短臂(6p21.33),是MHC I類鏈相關(guān)分子(MIC)家族的核心成員。該基因簇毗鄰HLA-B位點(diǎn),包含MICA和MICB兩個(gè)主要功能基因,二者在蛋白質(zhì)水平同源性達(dá)84%。與經(jīng)典MHCI類分子不同,MICB不結(jié)合β2微球蛋白,也不具備抗原肽呈遞功能,而是在細(xì)胞應(yīng)激狀態(tài)下表達(dá),作為配體特異性激活天然免疫系統(tǒng)的關(guān)鍵受體NKG2D(即KLRK1,又稱CD314),從而啟動(dòng)免疫監(jiān)視機(jī)制 [1]。?
MICB蛋白包含三個(gè)高度保守結(jié)構(gòu)域:細(xì)胞外的α1、α2結(jié)構(gòu)域構(gòu)成與NKG2D的結(jié)合界面;α3結(jié)構(gòu)域呈免疫球蛋白樣折疊,保障分子穩(wěn)定性;跨膜區(qū)則將其錨定在細(xì)胞膜上。此外,MICB的3'- 非翻譯區(qū)較長(zhǎng),基因呈現(xiàn)高度多態(tài)性,目前已鑒定出超225個(gè)等位基因,如中國(guó)南方漢族人群中的新等位基因MICB005:06和MICB026 [1,2]。
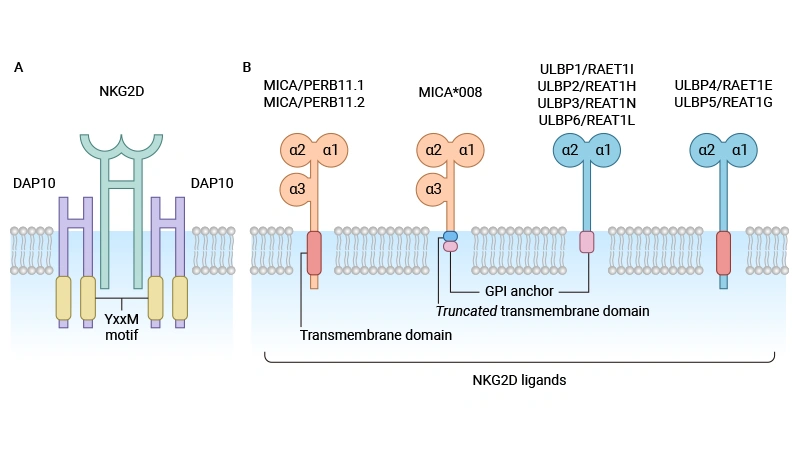
圖: NKG2D 受體和同源配體的結(jié)構(gòu) [11]
1.2 生物學(xué)功能
正常生理狀態(tài)下,MICB在健康細(xì)胞表面幾乎不表達(dá);但當(dāng)細(xì)胞遭遇DNA損傷、病毒感染、熱休克或氧化應(yīng)激等病理刺激時(shí),其表達(dá)顯著上調(diào) [3]。作為NKG2D的配體,MICB主要表達(dá)于應(yīng)激細(xì)胞表面,通過(guò)與NK細(xì)胞、CD8+ T細(xì)胞、γδ T細(xì)胞及活化巨噬細(xì)胞表面的NKG2D結(jié)合,激活天然免疫與適應(yīng)性免疫應(yīng)答,促使效應(yīng)細(xì)胞發(fā)揮細(xì)胞毒性并分泌細(xì)胞因子(如 IFN-γ)。這一機(jī)制在腫瘤免疫監(jiān)視中尤為關(guān)鍵,MICB陽(yáng)性的腫瘤細(xì)胞可被免疫系統(tǒng)識(shí)別并清除,構(gòu)成機(jī)體抗腫瘤的首道防線 [1,2,4]。
2. MICB的調(diào)控機(jī)制與信號(hào)通路
2.1 表達(dá)調(diào)控機(jī)制
● 轉(zhuǎn)錄與表觀調(diào)控:
MICB啟動(dòng)子區(qū)的單核苷酸多態(tài)性(SNP)可影響其轉(zhuǎn)錄活性。例如,rs1051788(G406A)變異導(dǎo)致MICB蛋白D136N氨基酸替換,降低細(xì)胞表面MICB表達(dá)及NKG2D結(jié)合能力 [3]。此外,microRNA-34a(miR-34a)可通過(guò)抑制轉(zhuǎn)錄因子E2F1并激活A(yù)TR激酶,雙重促進(jìn)MICB表達(dá),但其效應(yīng)依賴于細(xì)胞內(nèi)E2F1基礎(chǔ)水平 [5]。
● 翻譯后修飾與剪切:
腫瘤微環(huán)境中,MICB的表達(dá)受多種因素動(dòng)態(tài)調(diào)控。在基因水平,DNA損傷可激活A(yù)TM/ATR激酶途徑,直接上調(diào)MICB轉(zhuǎn)錄;表觀遺傳層面,啟動(dòng)子區(qū)域的甲基化狀態(tài)顯著影響其表達(dá)水平。此外,熱休克因子1(HSF1)和核因子κB(NF-κB)等轉(zhuǎn)錄因子可直接結(jié)合MICB啟動(dòng)子,促進(jìn)其表達(dá)。
除轉(zhuǎn)錄調(diào)控外,腫瘤細(xì)胞還可通過(guò)翻譯后修飾逃逸免疫監(jiān)視。例如,利用金屬蛋白酶ADAM10和ADAM17水解MICB跨膜區(qū),釋放可溶性MICB(sMICB),降低細(xì)胞表面配體密度 [4,6]。同時(shí),sMICB與NK細(xì)胞表面NKG2D持續(xù)結(jié)合,誘導(dǎo)受體內(nèi)吞和降解,導(dǎo)致NK細(xì)胞功能抑制。臨床數(shù)據(jù)顯示,黑色素瘤、前列腺癌等多種癌癥患者血清中 sMICB水平顯著升高,且與疾病進(jìn)展和不良預(yù)后密切相關(guān)。此外,腫瘤細(xì)胞還可通過(guò)表觀遺傳沉默、自噬 - 溶酶體途徑,或利用癌基因(如 RAS、MYC)直接抑制MICB啟動(dòng)子活性,減少M(fèi)ICB的表達(dá) [6]。
2.2 NKG2D-MICB信號(hào)通路
● 激活通路:
MICB與NKG2D結(jié)合后,可觸發(fā)不同免疫細(xì)胞內(nèi)的特異性信號(hào)級(jí)聯(lián)反應(yīng)。在NK細(xì)胞中,NKG2D胞內(nèi)區(qū)通過(guò)銜接蛋白DAP10傳遞活化信號(hào)。DAP10包含YINM基序,激活后招募并磷酸化PI3K和Grb2-Vav1通路,最終上調(diào)NF-κB和 MAPK信號(hào),促進(jìn)細(xì)胞因子(如 IFN-γ、TNF-α)分泌及細(xì)胞毒性顆粒(穿孔素、顆粒酶)的釋放。而在CD8+ T細(xì)胞中,MICB-NKG2D信號(hào)并不直接激活T細(xì)胞受體(TCR),而是作為共刺激信號(hào),增強(qiáng)TCR介導(dǎo)的細(xì)胞活化與增殖,并抑制活化誘導(dǎo)的細(xì)胞死亡(AICD),有效延長(zhǎng)效應(yīng)T細(xì)胞的生存時(shí)間。
● 抑制通路:
sMICB作為腫瘤免疫逃逸的關(guān)鍵分子,與NKG2D結(jié)合后可誘導(dǎo)受體內(nèi)吞和降解,降低效應(yīng)細(xì)胞活性。例如,登革熱患者血清中sMICB水平與疾病嚴(yán)重程度呈正相關(guān) ,表明其在免疫抑制中發(fā)揮重要作用 [7]。
3. MICB相關(guān)疾病
3.1 腫瘤性疾病?
MICB異常表達(dá)影響腫瘤進(jìn)展、轉(zhuǎn)移及耐藥。轉(zhuǎn)移性黑色素瘤和三陰性乳腺癌中,腫瘤細(xì)胞高表達(dá)ADAM17促進(jìn)MICB脫落,導(dǎo)致微轉(zhuǎn)移灶逃逸。2022年Nature研究表明,術(shù)后接種MICB疫苗的小鼠,肺轉(zhuǎn)移結(jié)節(jié)減少70%-80%,與CD4+ T、CD8+ T和NK細(xì)胞浸潤(rùn)分別增加29.3倍、17.9倍和38.9倍相關(guān) [8]。?
耐藥腫瘤模型(如 MHC-I、MHC-II 或 IFN-γ 受體缺陷)中,靶向MICB疫苗可激活CD4+ T和NK細(xì)胞,使50%-75%小鼠長(zhǎng)期無(wú)瘤生存。機(jī)制上,CD4+ T細(xì)胞分泌IFN-γ激活樹突狀細(xì)胞,招募NK細(xì)胞殺傷腫瘤 。此外,結(jié)直腸癌中高M(jìn)ICB 表達(dá)預(yù)示良好預(yù)后;多發(fā)性骨髓瘤則因sMICB 增多,高表達(dá)反與不良預(yù)后相關(guān) [6,9]。肝癌、胃癌通過(guò)E2F1抑制轉(zhuǎn)錄、STAT3下調(diào)表達(dá)逃逸免疫監(jiān)視 [5, 10]。?
3.2 炎癥與免疫相關(guān)疾病
● 自身免疫性疾病: 基因變異與系統(tǒng)性硬化癥(SSc)顯著相關(guān)。SSc患者皮膚細(xì)胞中MICB高表達(dá),激活NKG2D信號(hào),促進(jìn)T細(xì)胞浸潤(rùn)和膠原沉積。干擾素通路基因變異及NOTCH4基因協(xié)同加劇發(fā)病風(fēng)險(xiǎn)。
● 急性肺損傷(ALI)與原發(fā)性移植物功能障礙(PGD): 肺移植供體攜帶MICB rs1051788 AA基因型,可降低11.1%的嚴(yán)重PGD風(fēng)險(xiǎn) [3]。
● 感染性疾病: 登革熱患者中,MICB rs3132468變異與重癥風(fēng)險(xiǎn)相關(guān),或因sMICB抑制NKG2D [7]。?
3.3 慢性腎臟疾病
終末期腎病中,腎小管細(xì)胞炎癥誘導(dǎo)MICB高表達(dá),釋放的sMICB結(jié)合NK細(xì)胞NKG2D使其降解,削弱免疫功能,加劇腎功能惡化。血液透析患者血清sMICB水平與炎癥指標(biāo)CRP正相關(guān),降低sMICB可改善微炎癥狀態(tài)。
3.3 造血干細(xì)胞移植(HSCT)
HSCT中,供受者M(jìn)ICB錯(cuò)配與急性移植物抗宿主病(aGVHD)風(fēng)險(xiǎn)增加相關(guān),尤其是MICB*005:02等位基因錯(cuò)配時(shí),NK細(xì)胞介導(dǎo)的免疫反應(yīng)可能加劇組織損傷。
4. 基于MICB的藥物研發(fā)進(jìn)展
目前尚未有基于MICB靶點(diǎn)上市,多款藥物處于臨床前或臨床研究階段,最高研究階段臨床1期,已有積極的臨床結(jié)果公布,部分在研項(xiàng)目列舉如下:
| 藥物 | 作用機(jī)制 | 藥物類型 | 在研適應(yīng)癥(疾病名) | 在研機(jī)構(gòu) | 最高研發(fā)階段 |
| DM-919 | MICA抑制劑 | MICB抑制劑 | 單克隆抗體 | 晚期惡性實(shí)體瘤 | 丹碼(蘇州)生物醫(yī)藥科技有限公司 | 臨床1期 |
| CLN-619 | MICA抑制劑 | MICB抑制劑 | 單克隆抗體 | 復(fù)發(fā)性多發(fā)性骨髓瘤 | 晚期惡性實(shí)體瘤 | 非小細(xì)胞肺癌 | 胰腺癌 | Cullinan Oncology LLC | 臨床1期 |
| AHA-1031 | MICA抑制劑 | MICB抑制劑 | 雙特異性抗體 | STK11突變非小細(xì)胞肺癌 | The University of Texas Southwestern Medical Center | Aakha Biologics | Alloy Therapeutics, Inc. | 臨床前 |
| FT-836 | MICA抑制劑 | MICB抑制劑 | CAR-T | 實(shí)體瘤 | 腫瘤 | Fate Therapeutics, Inc. | Dana-Farber Cancer Institute, Inc. | 臨床前 |
| MICA/BxCD3(Xencor Inc.) | CD3刺激劑 | MICA抑制劑 | MICB抑制劑 | 雙特異性T細(xì)胞結(jié)合器 | 腫瘤 | Xencor, Inc. | 臨床前 |
| SYB-010 | MICA抑制劑 | MICB抑制劑 | 單克隆抗體 | 腫瘤 | CanCure LLC | 臨床前 |
| Tri-modal CAR+TCR+hnCD16+iPSC-derived T cells(Fate) | BCMA抑制劑 | CD16a調(diào)節(jié)劑 | MICA抑制劑 | MICB抑制劑 | NY-ESO-1抑制劑 | 誘導(dǎo)性多能干細(xì)胞 | CAR-T | 實(shí)體瘤 | Fate Therapeutics, Inc. | 臨床前 |
| BSI-120 | MICA抑制劑 | MICB抑制劑 | 單克隆抗體 | 腫瘤 | 博奧信生物技術(shù)(南京)有限公司 | 臨床前 |
| B10G5 | MICA抑制劑 | MICB抑制劑 | 自然殺傷細(xì)胞調(diào)節(jié)劑 | 單克隆抗體 | 多發(fā)性骨髓瘤 | 轉(zhuǎn)移性前列腺癌 | Severance Hospital | CanCure LLC | 臨床前 |
| ADI-925 | MICA抑制劑 | MICB抑制劑 | ULBP1抑制劑 | 通用型CAR-T | 實(shí)體瘤 | Adicet Therapeutics, Inc. | 臨床前 |
| GenSci-P107 | MICA抑制劑 | MICB抑制劑 | 雙特異性抗體 | 肝細(xì)胞癌 | 非小細(xì)胞肺癌 | 結(jié)直腸癌 | 胃癌 | 長(zhǎng)春金賽藥業(yè)有限責(zé)任公司 | 臨床前 |
5. MICB相關(guān)產(chǎn)品推薦
MICB作為NKG2D的關(guān)鍵配體,其表達(dá)與剪切平衡調(diào)控著免疫監(jiān)視與逃逸。當(dāng)前研究已揭示其在腫瘤、ALI及感染性疾病中的作用,而靶向MICB剪切的抗體藥物展現(xiàn)出臨床潛力。
華美生物提供MICB研究相關(guān)重組蛋白和ELISA試劑盒,協(xié)助您進(jìn)行MICB機(jī)制或臨床研究。
● MICB蛋白
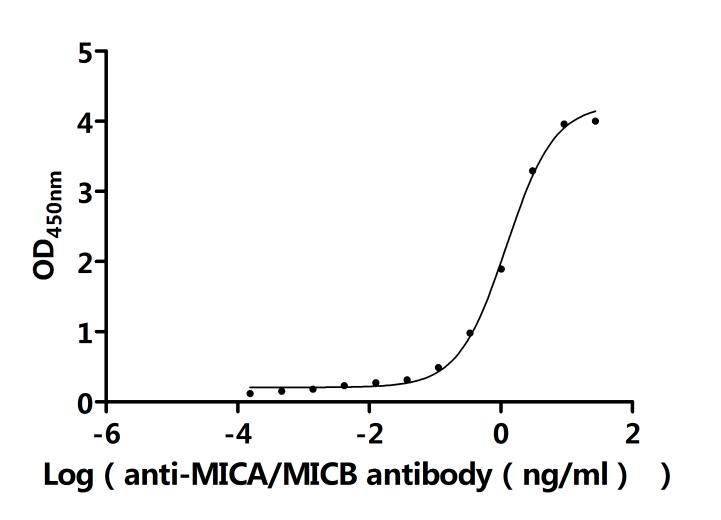
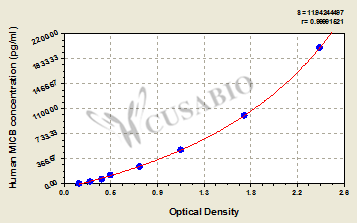
● MICB ELISA試劑盒
參考文獻(xiàn):
[1] Fang, Z.W., et al. (2021). A novel MICB allele, MICB*004:02, identified in a western china Uyghur individual. HLA.
[2] Liu, X., et al. (2012). MICB polymorphism in a southern Chinese Han population. Human Immunology.
[3] Aguilar, O.A., et al. (2024). MICB Genomic Variant Is Associated with NKG2D-mediated Acute Lung Injury and Death. Am J Respir Crit Care Med.
[4] Ferrari de Andrade, L., et al. (2018). Antibody-mediated inhibition of MICA and MICB shedding promotes NK cell-driven tumor immunity. Science.
[5] Zhou, M.T., et al. (2018). MicroRNA-34a Promotes MICB Expression in Hepatocytes. Carcinogenesis.
[6] Jinushi, M., et al. (2008). MHC class I chain-related protein A antibodies and shedding are associated with the progression of multiple myeloma. Proc Natl Acad Sci U S A.
[7] Khor, C.C., et al. (2011). Genome-wide association study identifies susceptibility loci for dengue shock syndrome at MICB and PLCE1. Nat Genet.
[8] Soumya Badrinath, et al. (2022). A vaccine targeting resistant tumours by dual T cell plus NK cell attack. Nature.
[9] Yu, S. (2019). High MICB expression confers prognostic benefit in colorectal cancer. Annals of Oncology.
[10] Li, Y., et al. (2010). MICB0106 gene polymorphism is associated with ulcerative colitis in central China. Int J Colorectal Dis.
[11] Eric Alves, et al. (2021). Manipulating the NKG2D Receptor-Ligand Axis Using CRISPR: Novel Technologies for Improved Host Immunity. Front Immunol.