B7-H6:NK細胞免疫檢查點的關鍵配體,重塑腫瘤免疫治療新格局
日期:2025-06-23 16:51:05
B7-H6,也稱為自然細胞毒性觸發受體3配體1(Natural Cytotoxicity Triggering Receptor 3 Ligand 1, NCR3LG1),是B7免疫共刺激/抑制分子家族中一個獨特的成員。它不組成性表達于正常組織,但在多種腫瘤細胞表面顯著高表達,并可由炎癥或感染信號誘導表達于免疫細胞和受損組織細胞。作為自然殺傷細胞(NK)關鍵活化性受體NCR3(NKp30)的主要功能性配體,B7-H6是介導NK細胞識別“非己”和“危險”信號、啟動細胞毒性殺傷的核心分子開關。其在腫瘤免疫逃逸中的核心作用,以及在感染免疫和炎癥調節中的潛在功能,使其成為當前腫瘤免疫治療和免疫調節藥物研發的前沿靶點。
1. B7-H6的結構、表達調控與核心功能機制
1.1 分子結構與受體結合特異性
B7-H6具有典型的B7家族胞外結構域:一個N端免疫球蛋白可變區樣結構域(IgV)和一個近膜免疫球蛋白恒定區樣結構域(IgC)。IgV結構域是結合NKp30的關鍵區域,決定了相互作用的特異性和親和力。其跨膜結構域將其錨定在細胞膜上,胞內結構域較短,提示其信號傳遞主要依賴于NKp30下游通路。B7-H6與NKp30的結合是高度特異性的,這種相互作用是NK細胞活化的重要觸發點。
1.2 動態表達調控
B7-H6的表達受到嚴格調控,在正常組織中極少表達,但在特定病理狀態下可被多種因素強烈誘導:
● 組成性高表達于多種腫瘤:廣泛存在于實體瘤(如結直腸癌、胃癌、卵巢癌、乳腺癌、黑色素瘤、神經母細胞瘤、淋巴瘤、膠質瘤等)和血液腫瘤(如白血病、淋巴瘤)細胞表面,是重要的腫瘤相關抗原。
● 誘導性表達:
(1)治療與應激誘導: 化療、放療、熱休克及細胞因子(TNF-α)等治療/應激因素顯著上調B7-H6。
(2)整合應激反應(ISR): 關鍵誘導通路,由PERK介導eIF2α磷酸化驅動。被特定藥物(HIV蛋白酶抑制劑、毒胡蘿卜素Tg)和病毒感染(如HCMV)利用。
(3)表觀遺傳調控: HDAC3上調促進表達(可被HDAC抑制劑阻斷);BRD4結合啟動子區并與JMJD6協同,招募轉錄機器促進轉錄(可被BET抑制劑JQ1阻斷)。
(4)轉錄因子驅動: 癌基因c-Myc直接上調B7-H6表達,兩者在多種腫瘤中表達正相關。
(5)炎癥信號: TLR配體及炎癥因子(TNF-α, IL-1β)可誘導特定免疫細胞(如炎性單核細胞、中性粒細胞)表達。
● 可溶性形式 (sB7-H6):通過蛋白酶切割或選擇性剪接產生,存在于血清和體液中。sB7-H6是重要的免疫抑制分子,能競爭性結合NKp30,阻斷膜型B7-H6介導的NK細胞活化,其血清水平與腫瘤負荷和不良預后相關。
1.3 雙重核心功能:腫瘤內在促癌效應與NK細胞活化調節
1.3.1 腫瘤內在促癌信號通路
B7-H6不僅是配體,其表達本身在腫瘤細胞內激活多條關鍵促生存、增殖和轉移的信號通路:
Ras/MEK/ERK通路: B7-H6誘導MEK、ERK和HIF-1α的磷酸化。激活的ERK1/2轉位入核,促進癌細胞存活、增殖、遷移和分化。B7-H6下調會抑制該通路。
PI3K/AKT通路: B7-H6激活PI3K/AKT信號。其下調會抑制該通路,影響細胞存活和代謝。
STAT3通路: B7-H6誘導STAT3活化,促進腫瘤發生。其下調會減少RNMT和c-Myc等STAT3下游效應分子的水平。
1.3.2 NK細胞活化的關鍵配體
激活NK細胞殺傷: 腫瘤細胞表面的膜型B7-H6與NK細胞表面的活化性受體NKp30結合,是觸發NK細胞殺傷的關鍵“激活信號”之一。
● 信號轉導: 結合導致NKp30胞內區ITAM(免疫受體酪氨酸激活基序)被Src家族激酶磷酸化,進而招募并激活Syk/ZAP70激酶。
● 下游通路激活:
PLCγ 裂解PIP2產生IP3和DAG,導致細胞內Ca2+濃度升高和PKC激活。
PI3K 產生PIP3,激活Akt等效應分子。
激活Vav,進而激活小G蛋白Rac,通過PAK1-MEK-ERK級聯激活MAPK通路。
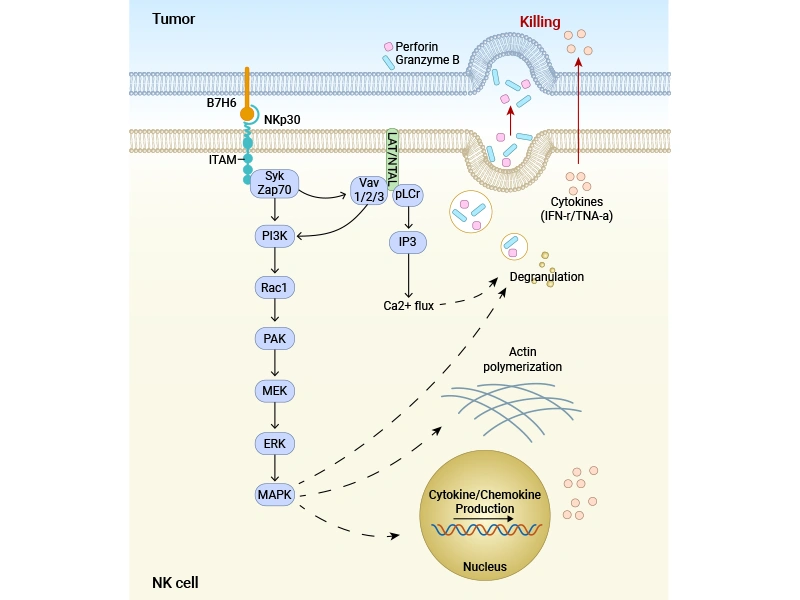
圖:B7-H6結合NKp30 誘導細胞裂解示意圖 [1]
2. B7-H6與疾病
2.1 B7-H6與炎癥
B7-H6在炎癥條件下可被誘導表達于非腫瘤細胞(如CD14?CD16?促炎單核細胞和中性粒細胞),并分泌可溶性形式(sB7-H6)。在膿毒癥中,膜結合型B7-H6(mB7-H6)通過結合NKp30激活NK細胞,加劇早期全身炎癥反應綜合征(SIRS),導致高死亡率;而外泌體來源的sB7-H6則阻斷NKp30信號通路,抑制NK細胞功能,促進代償性抗炎反應綜合征(CARS)階段的免疫麻痹,同樣增加患者死亡風險。革蘭陰性菌感染特異性地誘導sB7-H6產生,其機制可能與TLR4-TRIF通路相關。B7-H6的雙向免疫調節作用(促炎/抑炎)共同加劇膿毒癥病理進程,提示其動態監測可作為膿毒癥預后分層的新指標 [2]。
2.2 B7-H6與小細胞肺癌(SCLC)
B7-H6在SCLC中呈現獨特的雙向免疫調節作用 [3]:其高表達與無進展生存期(PFS)延長及免疫浸潤增加呈正相關,但與NK細胞活化呈負相關。機制上,B7-H6的膜結合形式可通過結合NKp30激活NK細胞抗腫瘤活性,而可溶性形式則抑制NK功能。相較于PD-L1,B7-H6在SCLC中表達更高且具有腫瘤特異性(正常組織幾乎不表達),是極具潛力的免疫治療新靶點(如ICI、CAR-T等)。但其動態表達模式、化療響應性及與可溶性形式的平衡需進一步研究。
2.3 B7-H6與T淋巴母細胞淋巴瘤(T-LBL)
B7-H6在T-LBL中首次被發現存在核轉位現象(依賴核定位信號NLS及轉運蛋白XPO-5/6),其表達與乳酸脫氫酶升高、ECOG評分、B癥狀等不良預后因素顯著相關,但受強化化療方案影響未直接關聯患者生存率 [4]。功能上,B7-H6通過雙重機制驅動疾病:① 膜/質型B7-H6(占比38.5%)可作為免疫治療靶點(NKp30-CAR-T體外有效清除腫瘤);② 細胞核型B7-H6可能通過非免疫途徑(如調控RAG-1基因)促進腫瘤發生,組蛋白去乙酰化酶抑制劑可抑制其表達。研究表明B7-H6是T-LBL潛在預后標志物及治療靶標,但其促腫瘤機制需進一步解析。
2.4 B7-H6與B細胞淋巴瘤(B-NHL)
B7-H6在B細胞淋巴瘤中高表達且驅動惡性進展:其敲除通過抑制STAT3通路(降低STAT3/ERK1/2磷酸化)顯著抑制腫瘤增殖(下調Survivin/PCNA/c-Myc)、阻滯G0/G1期(調控Cyclin D1-CDK4/6-Rb-p21軸)、促進凋亡(降低Bcl-2/Bcl-xL、升高Bax/Bad、激活Caspase-8/3)并增強化療敏感性;同時抑制轉移(下調MMP-2/9)。研究表明B7-H6通過STAT3信號軸協同調控淋巴瘤核心惡性表型,是潛在治療靶點 [5]。
2.5 B7-H6與肝細胞癌(HCC)
B7-H6在HCC中的表達與腫瘤體積正相關,低mRNA水平預示更好生存率 [6];功能上,敲除B7-H6可顯著抑制HCC細胞增殖、遷移和侵襲,阻滯細胞周期于G1期,并下調癌基因c-Myc/c-Fos及周期蛋白cyclin D1。機制上,B7-H6通過NKp30互作在HBV相關炎癥微環境中加劇肝損傷(如IL-32上調),同時直接調控腫瘤生物學行為,提示其兼具炎癥介導與癌基因雙重角色,是HCC潛在預后標志物及免疫治療靶點(如B7-H6-CAR-T)。
3. B7-H6的藥物研發現狀
根據數據庫顯示,B7-H6靶向藥物的研發現狀仍處于早期臨床驗證和適應癥探索擴展階段。其中,進展最快的是由勃林格殷格翰(Boehringer Ingelheim GmbH)開發的BI 765049,目前處于臨床I期。BI 765049是一種新型免疫球蛋白G(IgG)樣T細胞銜接器(TcE)(雙特異性抗體),其作用機制是通過同時結合T細胞表面的CD3和腫瘤細胞表達的B7-H6,激活T細胞并誘導其對腫瘤細胞的殺傷,目前主要在以胃癌、結直腸癌等B7-H6高表達率的消化道腫瘤中進行臨床探索。此外,靶向B7-H6的嵌合抗原受體T細胞療法療法(例如CAR-T和CAR-NK)以及單抗藥物也在進一步驗證中。
| 藥物 | 藥物類型 | 適應癥 | 在研機構 | 最高研發階段 |
| BI-765049 | 雙特異性T細胞結合器 | 結腸癌、胰腺導管腺癌、直腸癌、胃癌、頭頸部腫瘤、肝癌、非小細胞肺癌、胰腺癌、晚期惡性實體瘤、轉移性結直腸癌 | Boehringer Ingelheim GmbH | 臨床I期 |
| B7-H6 Targeted CAR-T(Adicet) | CAR-T | 腫瘤 | Adicet Bio, Inc. | 臨床前 |
| WO2023104062 | 單克隆抗體 | 感染、腫瘤 | Hefei TG ImmunoPharma Co., Ltd 肥天港免疫藥物有限公司 |
藥物發現 |
| WO2023147404 | CAR-NK | 免疫系統疾病、感染、腫瘤 | Rutgers State University of New Jersey | 藥物發現 |
表 B7-H6藥物研發管線(數據來源于Pharmsnap)
4. B7-H6靶向治療的未來展望
B7-H6作為腫瘤特異性抗原(正常組織低表達、腫瘤高表達),是癌癥免疫治療的理想靶點。未來需多維度推進其靶向治療:優化CAR-T/CAR-NK療法(如CAR-NK避免T細胞自相殘殺,優化CAR結構增強特異性與功能);聯合化療/放療誘導腫瘤B7-H6表達以提升敏感性;深入解析其調控機制(如MYC等轉錄因子作用)、B7H6/NKp30軸及膜/可溶性形式與免疫微環境互作;加速BiTE/ITE等新型療法的臨床轉化(如ITE與抗PD-1聯合試驗);最終推動其從臨床前研究向高效低毒的癌癥治療方案跨越。
5. 華美生物B7-H6相關產品
華美生物提供B7-H6相關高質量重組蛋白和抗體,旨在幫助科研工作者進行B7-H6作用機制與臨床轉化方向的研究:
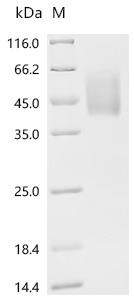
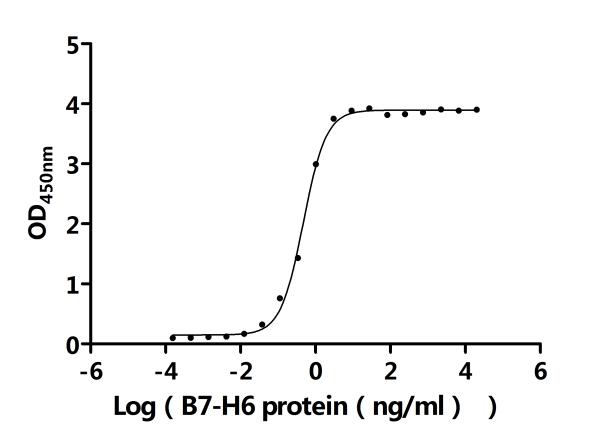
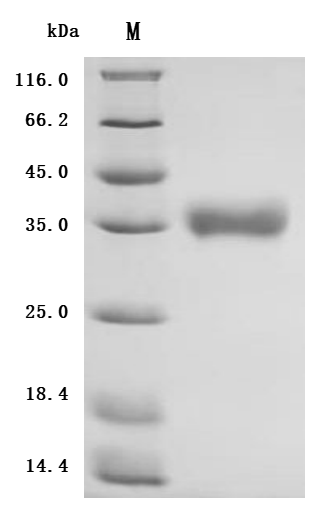
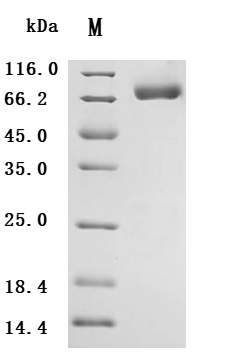
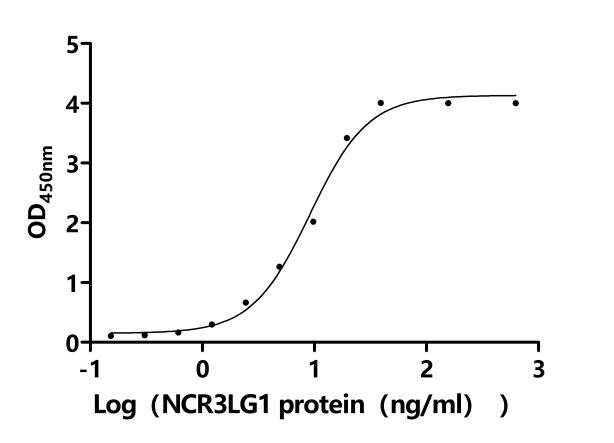
● B7-H6重組蛋白
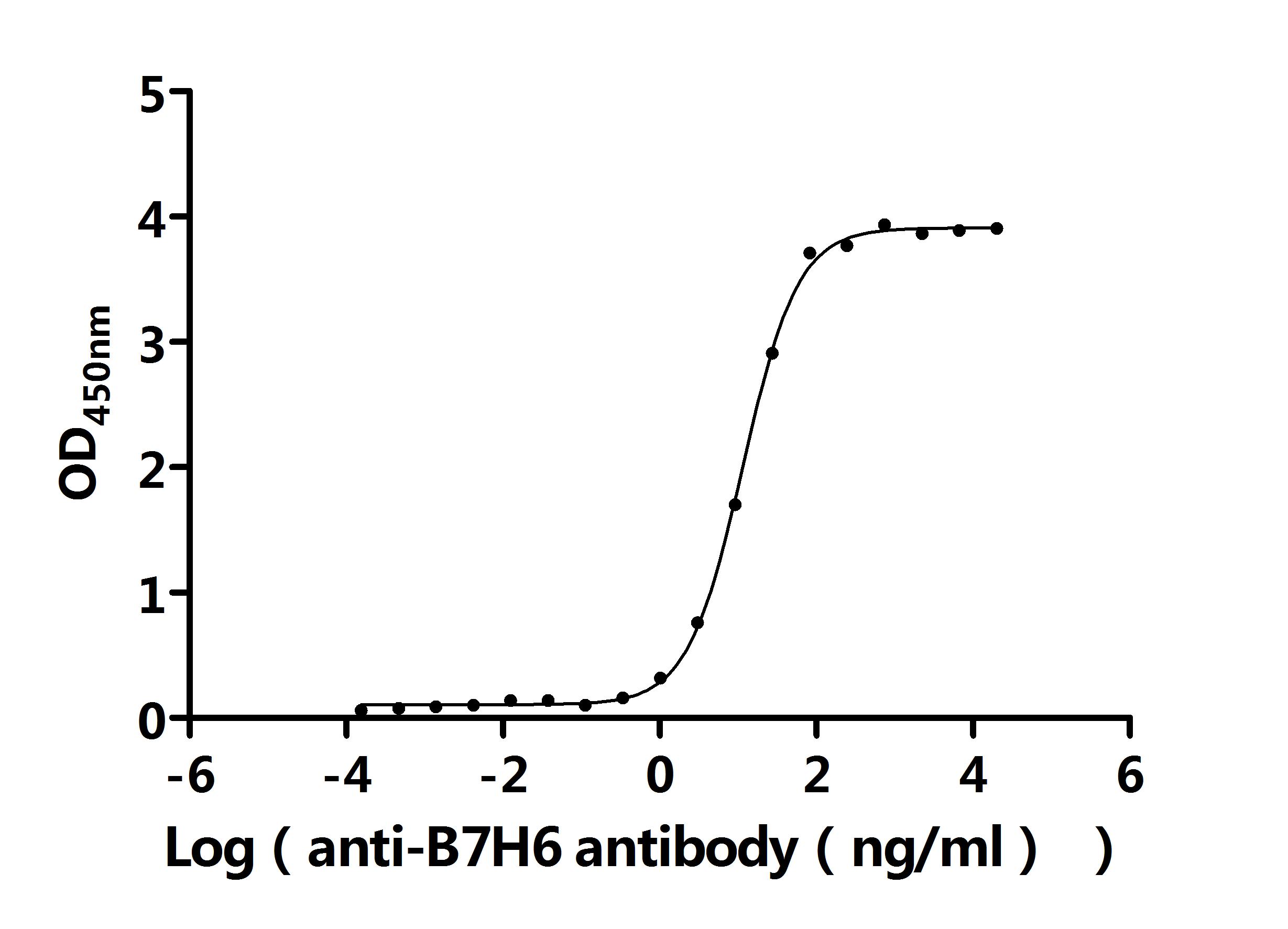
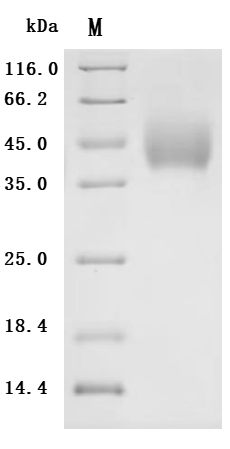
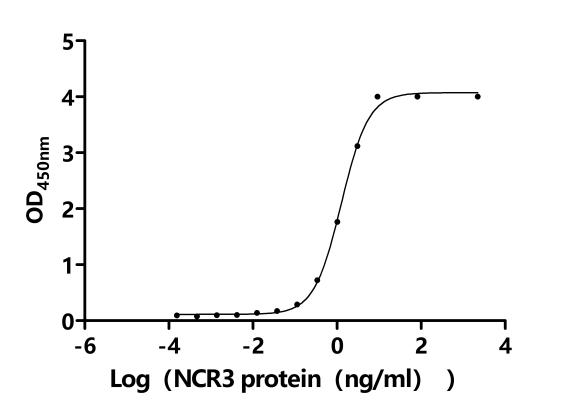
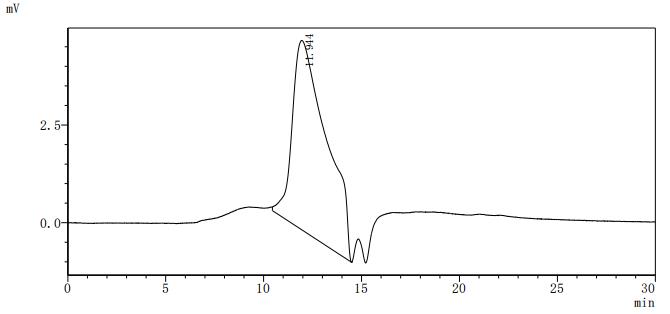
● B7-H6抗體
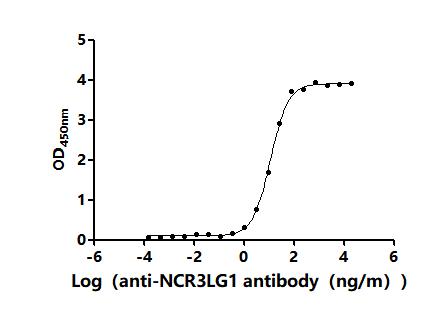
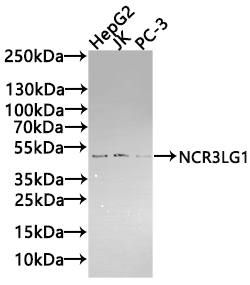
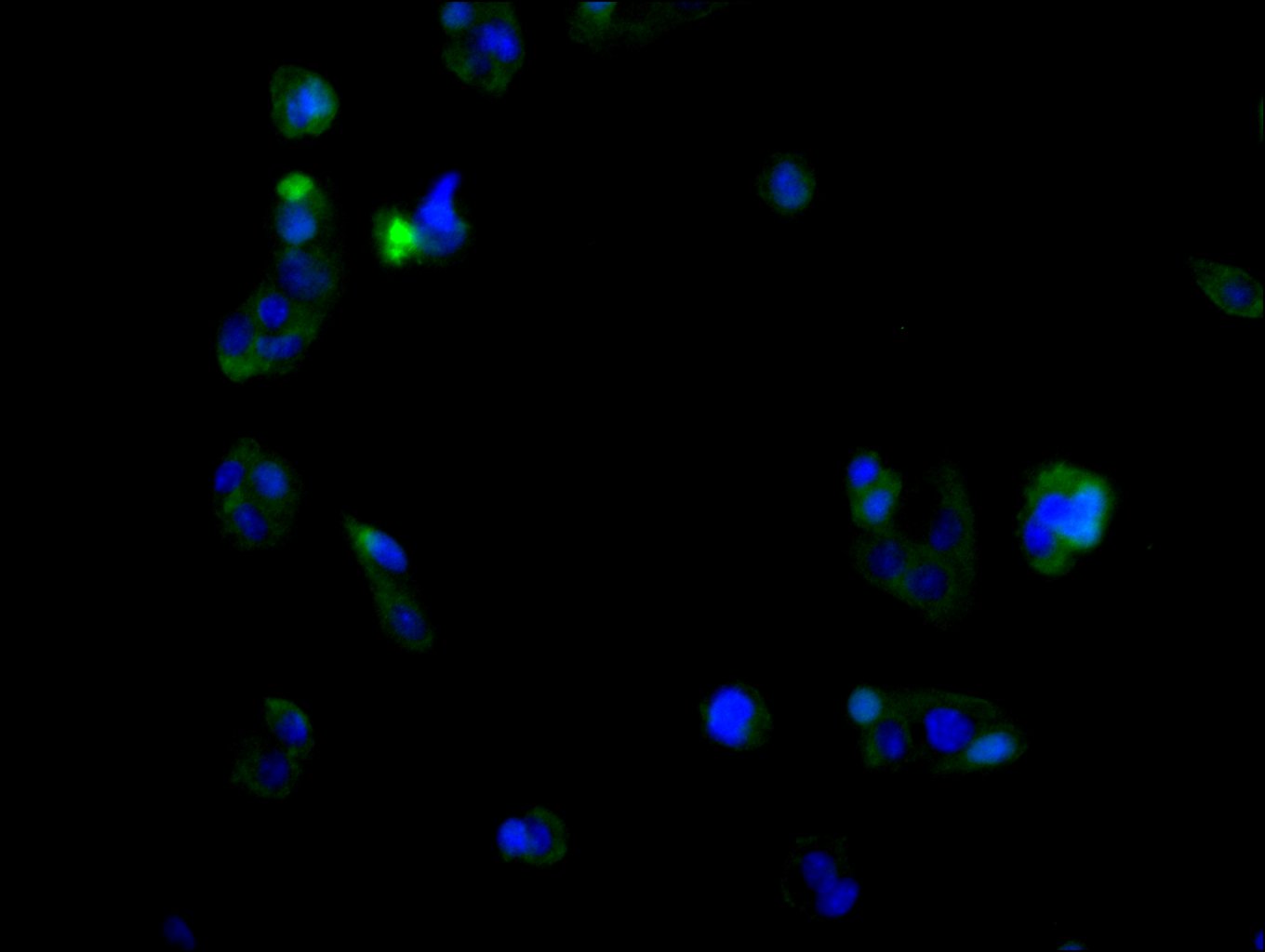
NCR3LG1 Recombinant Monoclonal Antibody; CSB-RA737873MA1HU
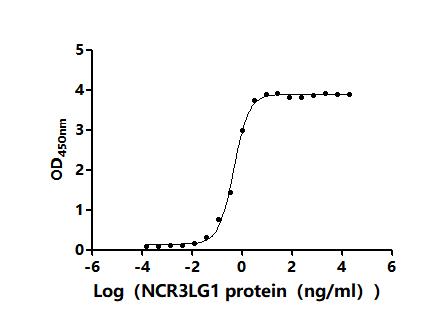
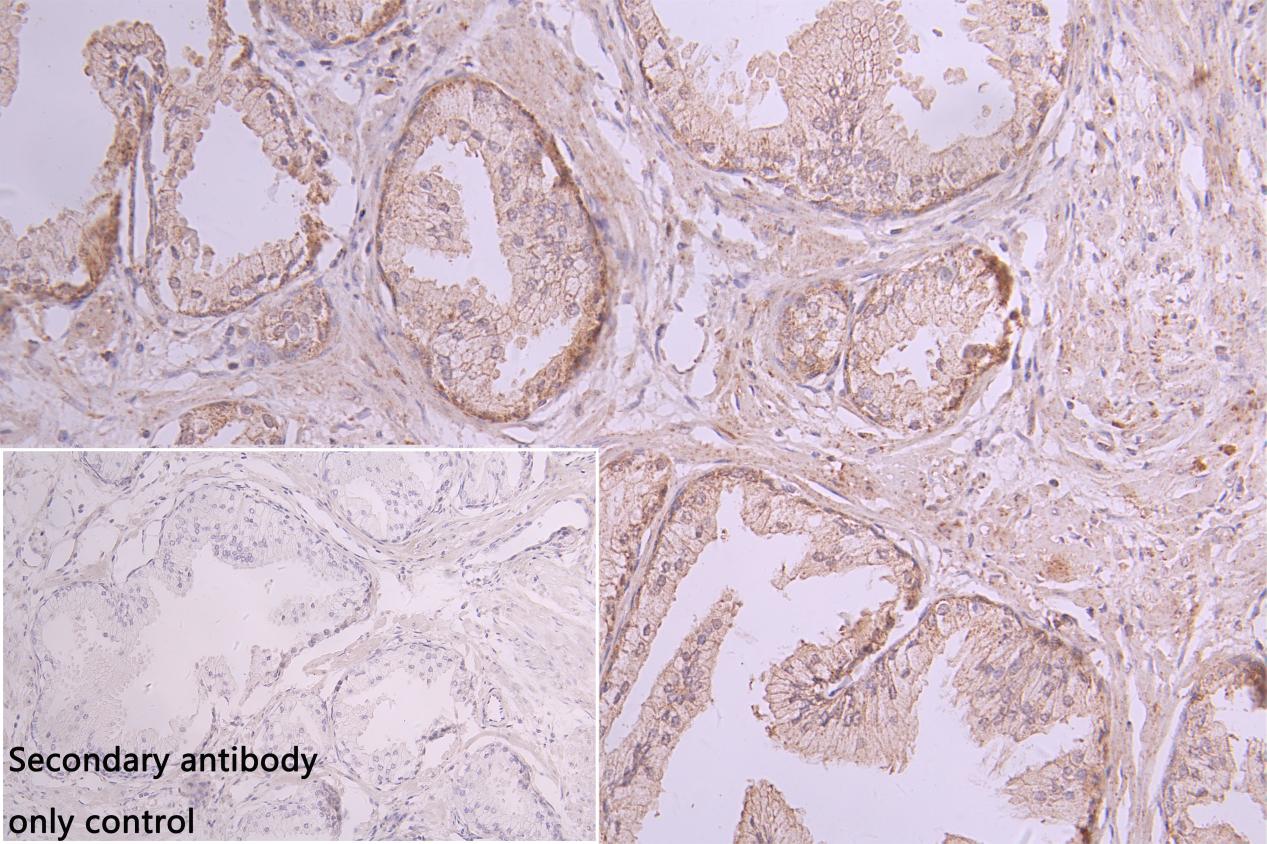
NCR3LG1 Antibody; CSB-PA737873LA01HU
參考文獻:
[1] Lee S, Kim JH, Jang IH, et al. Harnessing B7-H6 for Anticancer Immunotherapy: Expression, Pathways, and Therapeutic Strategies. Int J Mol Sci. 2024;25 (19).
[2] Matta J, Baratin M, Chiche L, et al. Induction of B7-H6, a ligand for the natural killer cell-activating receptor NKp30, in inflammatory conditions. Blood. 2013;122 (3):394-404.
[3] Thomas PL, Groves SM, Zhang YK, et al. Beyond Programmed Death-Ligand 1: B7-H6 Emerges as a Potential Immunotherapy Target in SCLC. J Thorac Oncol. 2021;16 (7):1211-1223.
[4] Yuan L, Sun L, Yang S, et al. B7-H6 is a new potential biomarker and therapeutic target of T-lymphoblastic lymphoma. Ann Transl Med. 2021;9 (4):328.
[5] Wu F, Wang J, Ke X. Knockdown of B7-H6 inhibits tumor progression and enhances chemosensitivity in B-cell non-Hodgkin lymphoma. Int J Oncol. 2016;48 (4):1561-70.
[6] Chen L, Feng J, Xu B, et al. B7-H6 expression in human hepatocellular carcinoma and its clinical significance [corrected]. Cancer Cell Int. 2018;18:126.










