MICA:腫瘤免疫監視的關鍵調節分子及其治療靶點潛力
日期:2025-06-25 13:14:56
1. MICA的背景介紹
MICA(Major Histocompatibility Complex Class I-Related Chain A)是一種重要的應激誘導型細胞表面糖蛋白,屬于MHC I類相關蛋白家族。其基因位于人類6號染色體的MHC區域,緊鄰HLA-B locus,編碼的蛋白由 α1、α2、α3結構域及跨膜區和胞內區組成。MICA蛋白主要表達于上皮細胞、內皮細胞和某些腫瘤細胞表面,而在正常外周血淋巴細胞中不表達 [1,2]。
作為NKG2D(Natural Killer Group 2D)受體的主要配體,MICA在機體免疫監視中發揮關鍵作用。NKG2D廣泛表達于NK細胞、CD8+ T細胞和γδ T細胞表面,當MICA與NKG2D結合后,能激活這些細胞的細胞毒作用,誘導對異常細胞的殺傷 [3,4]。值得注意的是,MICA基因具有高度多態性,目前已報道的等位基因超過400 種,這種多態性可能影響其與NKG2D的結合親和力及免疫應答強度 [5,6]。
2. MICA的作用機制與信號通路
2.1 MICA的表達調控與脫落機制
MICA的表達受細胞應激信號調控,如DNA損傷、氧化應激或惡性轉化等。在腫瘤細胞中,基因組不穩定性常導致MICA基因的轉錄激活,使其在細胞表面高表達[7,8]。然而,腫瘤細胞可通過蛋白酶解作用剪切MICA分子,使其從細胞表面脫落形成可溶性MICA(sMICA)。研究表明,ADAM10、ADAM17等金屬蛋白酶參與了這一過程,剪切位點位于MICA的α3結構域 [2,8]。sMICA不僅能降低腫瘤細胞表面NKG2D配體的密度,還能與循環中的NKG2D結合,導致受體內化和降解,從而削弱NK細胞和T細胞的抗腫瘤活性 [4,8]。
2.2 NKG2D-MICA信號通路
NKG2D與MICA的結合啟動的信號通路主要依賴于接頭蛋白DAP10(DNAX-Activating Protein of 10 kDa)。DAP10含有一個ITAM(Immunoreceptor Tyrosine-Based Activation Motif)樣基序,與NKG2D結合后,通過招募PI3K(Phosphatidylinositol 3-Kinase)和Akt激酶,激活下游的MAPK(Mitogen-Activated Protein Kinase)和NF-κB(Nuclear Factor kappa-B)信號通路,最終促進細胞毒性分子(如穿孔素、顆粒酶)的釋放和細胞因子(如IFN-γ)的分泌 [3,4]。
在NK細胞中,該信號通路與抑制性受體(如KIRs)的平衡決定了NK細胞的活化狀態。當MICA高表達且抑制性信號較弱時,NK細胞被充分激活,發揮抗腫瘤作用 [8]。而在腫瘤微環境中,sMICA的積累可競爭性結合NKG2D,干擾這一信號通路,導致免疫逃逸 [2,8]。
3. MICA相關疾病
3.1 惡性腫瘤?
● 乳腺癌:在三陰性乳腺癌(TNBC)中,MICA和MICB的表達水平與NK細胞浸潤呈正相關。研究發現,TNBC患者血清中sMICA水平升高與不良預后相關,而miR-486-5p可通過靶向調控MICA的表達,增強NK細胞對腫瘤細胞的殺傷作用 [7,9]。
● 腎癌與黑色素瘤:在腎癌細胞表面的高表達可作為NK細胞攻擊的靶點,但腫瘤細胞通過脫落MICA逃避免疫監視。在黑色素瘤中,MICA的表達與腫瘤進展和轉移密切相關 [8,10]。
● 其他腫瘤:在結直腸癌、卵巢癌、胰腺癌等多種實體瘤中均有異常表達,其脫落水平可作為評估腫瘤進展和預后的生物標志物 [1,2]。?
3.2 器官移植排斥反應
腎移植研究表明,供受者之間的MICA錯配與移植腎存活率降低顯著相關。術前存在抗MICA供者特異性抗體(DSA)的患者,術后抗體介導的排斥反應(ABMR)發生率顯著升高,而術后新發的抗MICA DSA與移植腎失功風險增加相關 [2,6]。此外,MICA抗體與HLA抗體在移植排斥中存在協同作用,兩者共同存在時ABMR風險顯著升高 [6]。
4. 基于MICA靶點的藥物研究進展
2025年2月,浙江大學團隊開發的靶向MICA/B α3表位的mRNA疫苗mCM10-L在《Cell Reports Medicine》發表,通過阻斷MICA/B α1/2脫落激活免疫細胞,顯著抑制多種腫瘤轉移 [11]。與此同時,多條MICA靶向藥物正處于臨床前或臨床研究階段,以實體瘤為主要適應癥。部分在研管線列舉如下表:
| 藥物 | 作用機制 | 藥物類型 | 在研適應癥 | 在研機構 | 最高研發階段 |
| DM-919 | MICA抑制劑 | MICB抑制劑 | 單克隆抗體 | 晚期惡性實體瘤 | 丹碼(蘇州)生物醫藥科技有限公司 | 臨床1期 |
| CLN-619 | MICA抑制劑 | MICB抑制劑 | 單克隆抗體 | 復發性多發性骨髓瘤 | 晚期惡性實體瘤 | 非小細胞肺癌 | 胰腺癌 | Cullinan Oncology LLC | 臨床1期 |
| AHA-1031 | MICA抑制劑 | MICB抑制劑 | 雙特異性抗體 | STK11突變非小細胞肺癌 | The University of Texas Southwestern Medical Center | Aakha Biologics | Alloy Therapeutics, Inc. | 臨床前 |
| FT-836 | MICA抑制劑 | MICB抑制劑 | CAR-T | 實體瘤 | 腫瘤 | Fate Therapeutics, Inc. | Dana-Farber Cancer Institute, Inc. | 臨床前 |
| MICA/BxCD3(Xencor Inc.) | CD3刺激劑 | MICA抑制劑 | MICB抑制劑 | 雙特異性T細胞結合器 | 腫瘤 | Xencor, Inc. | 臨床前 |
| SYB-010 | MICA抑制劑 | MICB抑制劑 | 單克隆抗體 | 腫瘤 | CanCure LLC | 臨床前 |
| Tri-modal CAR+TCR+hnCD16+iPSC-derived T cells(Fate) | BCMA抑制劑 | CD16a調節劑 | MICA抑制劑 | MICB抑制劑 | NY-ESO-1抑制劑 | 誘導性多能干細胞 | CAR-T | 實體瘤 | Fate Therapeutics, Inc. | 臨床前 |
| JZC01 | MICA抑制劑 | VEGFR2拮抗劑 | 雙特異性抗體 | 腫瘤 | 中國藥科大學 | 臨床前 |
| BSI-120 | MICA抑制劑 | MICB抑制劑 | 單克隆抗體 | 腫瘤 | 博奧信生物技術(南京)有限公司 | 臨床前 |
| IPH4301 | DNA抑制劑 | MICA抑制劑 | ADC | 腫瘤 | Innate Pharma SA | 臨床前 |
| IPH-43 | DNA抑制劑 | MICA抑制劑 | ADC | 實體瘤 | AstraZeneca PLC | 臨床前 |
| B10G5 | MICA抑制劑 | MICB抑制劑 | 自然殺傷細胞調節劑 | 單克隆抗體 | 多發性骨髓瘤 | 轉移性前列腺癌 | Severance Hospital | CanCure LLC | 臨床前 |
| ADI-925 | MICA抑制劑 | MICB抑制劑 | ULBP1抑制劑 | 通用型CAR-T | 實體瘤 | Adicet Therapeutics, Inc. | 臨床前 |
| PDL1sFv/MICAe | MICA抑制劑 | PDL1抑制劑 | 抗體 | 融合蛋白 | 腫瘤 | Clemson University | 臨床前 |
| GenSci-P107 | MICA抑制劑 | MICB抑制劑 | 雙特異性抗體 | 肝細胞癌 | 非小細胞肺癌 | 結直腸癌 | 胃癌 | 長春金賽藥業有限責任公司 | 臨床前 |
5. CUSABIO相關產品推薦
MICA作為NKG2D的關鍵配體,在腫瘤免疫監視和移植排斥中扮演重要角色。其獨特的表達調控和脫落機制為開發新型免疫治療藥物提供了靶點。華美生物提供MICA蛋白、抗體、ELISA試劑盒,助力您在MICA免疫抑制作用機制或藥物開發方向的研究。
● MICA重組蛋白
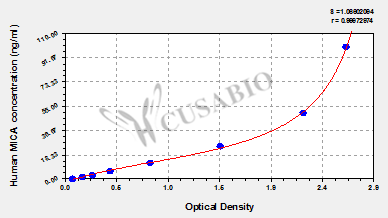
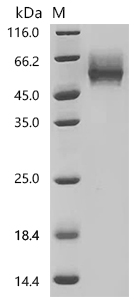
Recombinant Human MHC Class I chain-related protein (MICA), partial (Active); CSB-MP5605HU
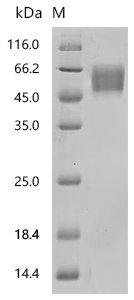
Recombinant Human MHC Class I chain-related protein (MICA), partial (Active); CSB-MP5606HU
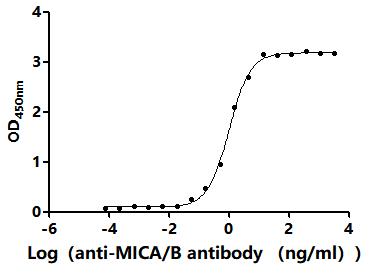
● MICA抗體
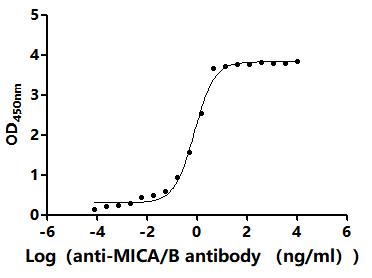
MICA Recombinant Monoclonal Antibody; CSB-RA574653A0HU
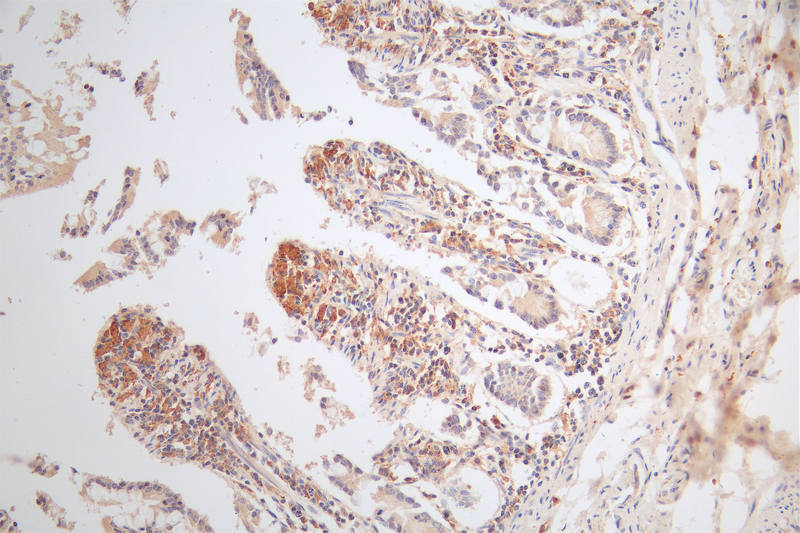
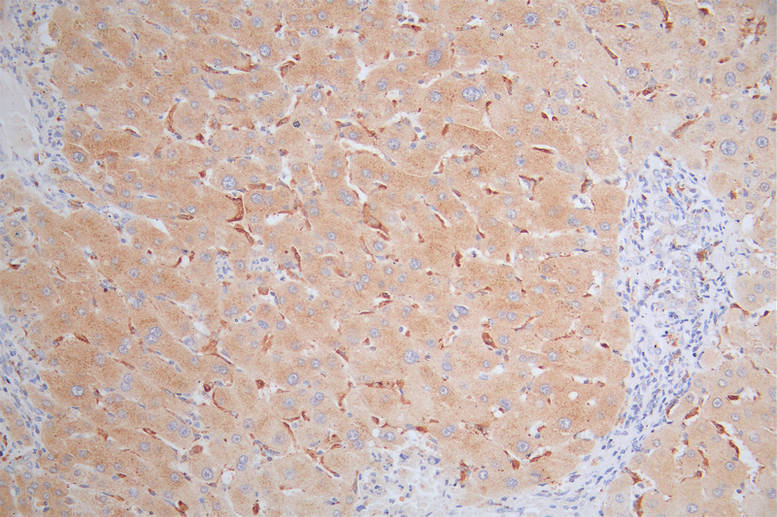
MICA Antibody; CSB-PA013806ESR2HU
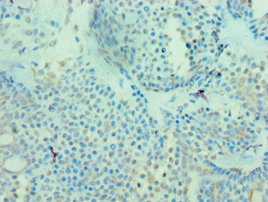
● MICA ELISA試劑盒
參考文獻:
[1] Zou Y, et al. Antibodies against MICA antigens and kidney-transplant rejection. The New England Journal of Medicine, 2007.
[2] Carapito R, et al. The MHC class I MICA gene is a histocompatibility antigen in kidney transplantation. Nature Medicine, 2022.
[3]Bauer S, et al. Activation of NK cells and T cells by NKG2D, a receptor for stress-inducible MICA. Science, 1999.
[4] Raulet DH, et al. Regulation of ligands for the NKG2D activating receptor. Annual Review of Immunology, 2013.
[5] Klussmeier A, et al. High-throughput MICA/B genotyping of over two million samples: workflow and allele frequencies. Frontiers in Immunology, 2020.
[6] Zou Y, et al. Antibodies against MICA antigens and kidney-transplant rejection: reply. The New England Journal of Medicine, 2008.
[7] Abdel-Latif M, et al. A new quercetin glycoside enhances TNBC immunological profile through TP53/miR-155/MICA/ULBP2. Annals of Oncology, 2019.
[8] Ferrari de Andrade L, et al. Antibody-mediated inhibition of MICA and MICB shedding promotes NK cell-driven tumor immunity. Science, 2018.
[9] Elkhouly A, et al. miR-486-5p counteracts the shedding of MICA/B and CD155 immune-ligands in TNBC patients. Annals of Oncology, 2019.
[10] Badrinath S, et al. Promoting T and NK cell attack: preserving tumor MICA/B by vaccines. Cell Research, 2022.
[11] Rui Wang, et al. An epitope-directed mRNA vaccine inhibits tumor metastasis through the blockade of MICA/B α1/2 shedding. Cell Rep Med, 2025.