LYPD3:實體瘤治療的潛力之星
日期:2025-06-30 17:00:22
1. LYPD3概述
LYPD3(Ly6/PLAUR Domain-Containing Protein 3)又名C4.4A,是一種糖基磷脂酰肌醇(GPI)錨定的細(xì)胞膜蛋白,在腫瘤進展、細(xì)胞遷移和組織修復(fù)中扮演關(guān)鍵角色。近年來,LYPD3在腫瘤生物醫(yī)學(xué)領(lǐng)域受到廣泛關(guān)注。研究表明,其在多種惡性腫瘤中呈現(xiàn)顯著高表達,包括乳腺癌、非小細(xì)胞肺癌、急性髓系白血病和黑色素瘤。
2. LYPD3在腫瘤中的表達及其臨床意義
眾多研究證實,LYPD3在多種腫瘤組織中的表達顯著高于正常組織。在乳腺癌中,LYPD3的表達受β2-腎上腺素能信號調(diào)控,促進腫瘤細(xì)胞遷移和侵襲,敲低LYPD3可顯著抑制腫瘤細(xì)胞活性。值得一提的是,LYPD3在乳腺癌原發(fā)灶和轉(zhuǎn)移灶中有表達,但在正常乳腺組織中未檢測到表達 [1]。此外,在肺腺癌(LUAD)中,與癌旁組織相比,LYPD3在腫瘤組織中的表達顯著上調(diào)。更為關(guān)鍵的是,LYPD3的高表達與患者的種族、腫瘤階段以及生存狀態(tài)存在著顯著的關(guān)聯(lián)。具體而言,LYPD3表達水平越高,患者的生存狀態(tài)往往越差,并且隨著LUAD疾病階段的不斷進展,LYPD3的表達水平也呈現(xiàn)出顯著上升的趨勢 [2]。
3. LYPD3與腫瘤侵襲和轉(zhuǎn)移
LYPD3在腫瘤侵襲和轉(zhuǎn)移中的關(guān)鍵作用已被多項研究所證實。在非小細(xì)胞肺癌中,LYPD3的高表達與腫瘤細(xì)胞增殖和凋亡抑制相關(guān),且與腫瘤侵襲性表型相關(guān) [2]。同時,在頭頸鱗癌和非小細(xì)胞肺癌中,LYPD3通過與miRNA(如miR-151-5p、miR-124-3p)及長鏈非編碼RNA(如OGFRP1)發(fā)生相互作用,調(diào)控腫瘤細(xì)胞的遷移、侵襲和增殖,且其高表達與患者預(yù)后不良密切相關(guān) [3][4]。研究還顯示,LYPD3通過維持腫瘤干性細(xì)胞特性,促進腫瘤細(xì)胞的自我更新和耐藥性,從而加劇腫瘤的侵襲性和轉(zhuǎn)移能力,已在黑色素瘤和結(jié)直腸癌等多種腫瘤中得到證實 [5][6]。
4. LYPD3與腫瘤免疫微環(huán)境
LYPD3在塑造腫瘤免疫微環(huán)境方面具有重要作用。在黑色素瘤中,LYPD3與免疫抑制標(biāo)記物S100A9共同表達,并且與免疫抑制性腫瘤微環(huán)境相關(guān),其表達與腫瘤浸潤性T細(xì)胞的數(shù)量呈負(fù)相關(guān),表明LYPD3可能通過調(diào)節(jié)免疫細(xì)胞的浸潤來影響腫瘤的發(fā)展和治療反應(yīng)[5]。此外,在急性髓系白血病(AML)中,LYPD3的高表達與不良預(yù)后相關(guān),并且可能通過調(diào)節(jié)P53和/或PI3K/AKT信號通路參與AML的發(fā)展。實驗數(shù)據(jù)顯示,使用siRNA抑制LYPD3表達后,AML細(xì)胞系HL-60的增殖能力受到抑制,且細(xì)胞凋亡相關(guān)指標(biāo)顯著上調(diào),表明LYPD3對AML細(xì)胞的增殖和存活具有重要促進作用[7]。
5. LYPD3作為治療靶點的潛力
鑒于LYPD3在多種腫瘤中的異常表達及其與腫瘤進展的密切關(guān)系,LYPD3有望成為腫瘤治療的新靶點。
在乳腺癌中,LYPD3的表達受β2-腎上腺素能信號調(diào)控,促進腫瘤細(xì)胞遷移和侵襲,敲低LYPD3可顯著抑制腫瘤細(xì)胞活性,顯示其為潛在治療靶點 [1]。在黑色素瘤中,JUP/AGR2/LYPD3信號軸不僅維持腫瘤干性,還促進糖酵解,并與免疫抑制性腫瘤微環(huán)境密切相關(guān),提示LYPD3有助于腫瘤免疫逃逸 [5]。此外,在肺癌中,LYPD3的高表達與不良預(yù)后、腫瘤分期及免疫細(xì)胞浸潤密切相關(guān),且影響細(xì)胞周期、DNA復(fù)制等多條信號通路 [8]。值得一提的是,除了皮膚角質(zhì)細(xì)胞和食管真皮細(xì)胞以外,LYPD3在正常組織上幾乎不表達,這一特性使得靶向LYPD3的治療具有較高的特異性,有望在精準(zhǔn)打擊腫瘤細(xì)胞的同時,減少對正常組織的損傷。綜合LYPD3在腫瘤調(diào)控中的多重關(guān)鍵機制,它已然成為腫瘤診斷、預(yù)后評估及靶向治療中備受矚目的重要分子,有望為實體瘤治療開辟全新的途徑,為患者帶來更有效的治療方案和更好的預(yù)后效果。
6. LYPD3的藥物研發(fā)現(xiàn)狀
針對LYPD3靶點的在研藥物類型主要為單克隆抗體,適應(yīng)癥為腫瘤。以下是LYPD3在研單抗管線:
| 藥物 | 藥物類型 | 在研適應(yīng)癥 | 在研機構(gòu) | 最高研發(fā)階段 |
| GT-002(PentixaPharm) | 單克隆抗體 | 腫瘤 | PentixaPharm GmbH | 臨床前 |
| GT-002 (Glycotope) | 單克隆抗體 | 腫瘤 | Glycotope GmbH | 藥物發(fā)現(xiàn) |
(數(shù)據(jù)來源于Pharmsnap)
7. 相關(guān)產(chǎn)品推薦
● LYPD3重組蛋白
Recombinant Human Ly6/PLAUR domain-containing protein 3 (LYPD3) (Active); CSB-MP013263HU
Recombinant Mouse Ly6/PLAUR domain-containing protein 3 (Lypd3), partial (Active); CSB-MP849681MO1
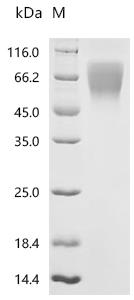
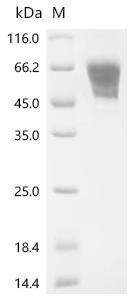
Recombinant Rat Ly6/PLAUR domain-containing protein 3 (Lypd3) (Active); CSB-MP013263RA
● LYPD3重組抗體
LYPD3 (Lupartumab) Recombinant Monoclonal Antibody; CSB-RA013263MA2HU
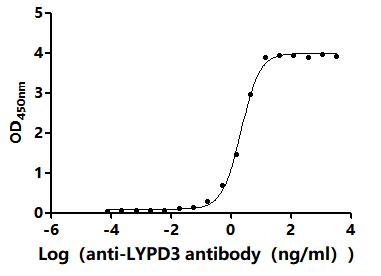
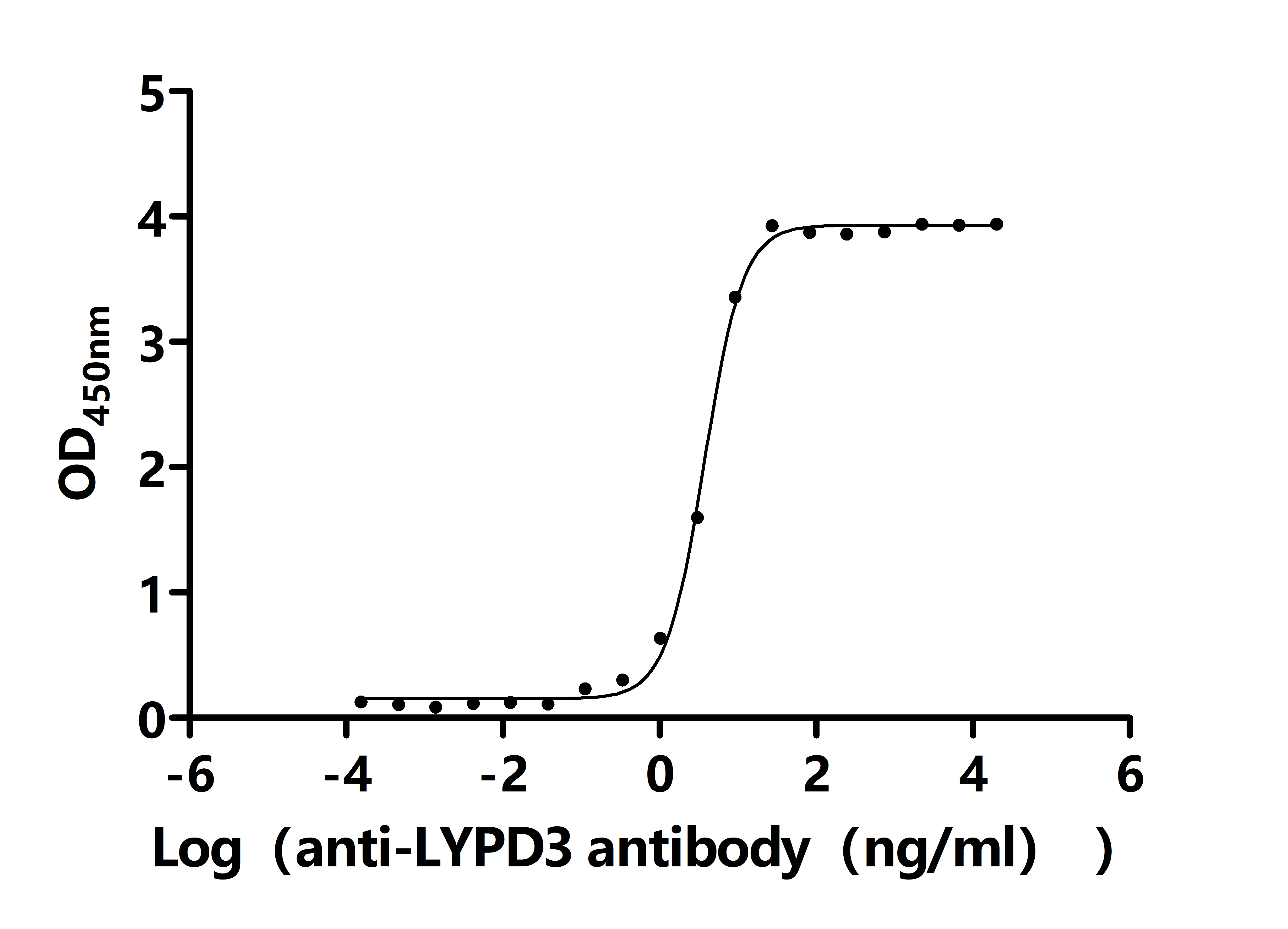
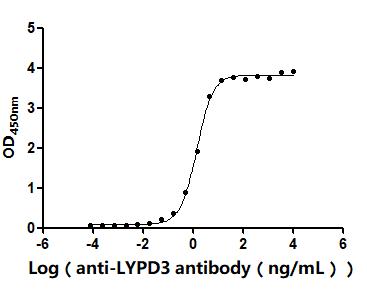
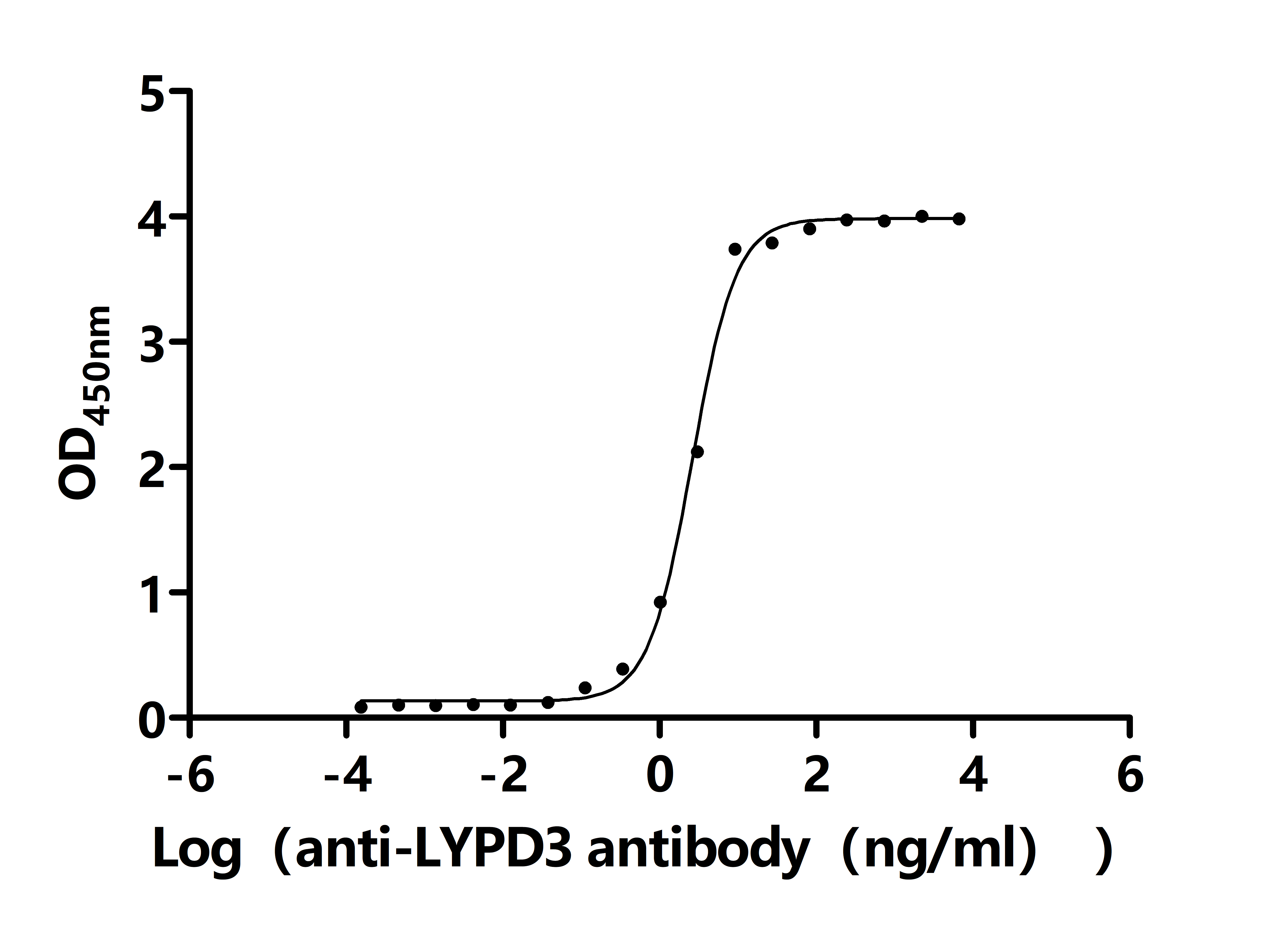
The Binding Activity of Human LYPD3 with Anti-LYPD3 recombinant antibody
Activity: Measured by its binding ability in a functional ELISA. Immobilized Human LYPD3(CSB-MP013263HU) at 2 μg/mL can bind Anti-LYPD3 recombinant antibody. The EC50 is 2.375-2.905 ng/mL.
● LYPD3 ELISA試劑盒
參考文獻:
[1] Gruet, M., Cotton, D., Coveney, C., Boocock, D., Wagner, S., Komorowski, L., Rees, R., Pockley, A., Garner, A., Wallis, J., Miles, A., Powe, D., & Powe, D. (2020). β2-Adrenergic Signalling Promotes Cell Migration by Upregulating Expression of the Metastasis-Associated Molecule LYPD3. Biology, 9.
[2] Ying Huang et al. "Elevated Expression of LYPD3 Is Associated with Lung Adenocarcinoma Carcinogenesis and Poor Prognosis.." DNA and cell biology (2020).
[3] Yufei Hua et al. "m6A-dependent mature miR-151-5p accelerates the malignant process of HNSCC by targeting LYPD3." Molecular Biomedicine, 5 (2024).
[4] Yan Zhang et al. "Long non-coding RNA OGFRP1 regulates LYPD3 expression by sponging miR-124-3p and promotes non-small cell lung cancer progression.." Biochemical and biophysical research communications, 505 2 (2018): 578-585.
[5] Yuan-Jie Liu et al. "LY6/PLAUR domain containing 3 (LYPD3) maintains melanoma cell stemness and mediates an immunosuppressive microenvironment." Biology Direct, 18 (2023).
[6] T. Kanaseki et al. "LY6/PLAUR domain containing 3 has a role in the maintenance of colorectal cancer stem-like cells.." Biochemical and biophysical research communications, 486 2 (2017): 232-238.
[7] Tingting Hu et al. "LYPD3, a New Biomarker and Therapeutic Target for Acute Myelogenous Leukemia." Frontiers in Genetics, 13 (2022).
[8] Xinyao Xu et al. "Comprehensive analysis of exosome gene LYPD3 and prognosis/immune cell infiltration in lung cancer." Translational Cancer Research, 13 (2023): 1394 - 1405.