Th17細胞的分化
日期:2023-11-17 12:02:00
根據細胞分化和功能特性,CD4+細胞被分為Th1、Th2和調節性T細胞(Treg)等亞群。近期的研究發現了一種新的CD4+ T效應T輔助細胞——Th17細胞,它與Th1型和Th2型不同,在IL-6和IL-23的刺激下由TH0細胞分化而來,主要分泌IL-17、IL-22等促炎因子。與Th1、Th2和Treg細胞一起,它們構成了CD4+細胞的四個亞群。在自身免疫性疾病、傳染病和移植排斥中起著重要的調節作用 [1]。
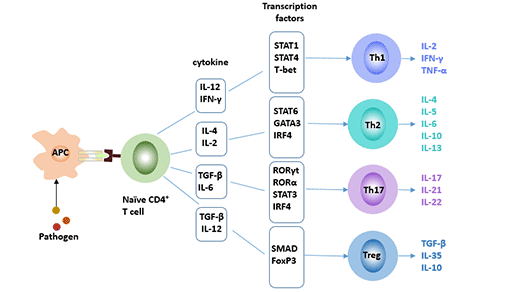
圖1. CD4+ T細胞的四個亞群
1. Th17細胞的發現
Th17細胞是由Harrington等人于2005年發現的 [2]。Th17細胞主要根據它們分泌的細胞因子命名。通過建立自身免疫性腦炎和膠原誘導性關節炎的小鼠模型,證實了這些細胞的存在。Th17細胞在自身免疫性疾病和免疫防御反應中具有重要意義 [3]。Th17細胞的發現為治療自身免疫性疾病提供了新的靶點。
2. Th17細胞的細胞標記
在人體內,可以通過細胞表面標志物CD4、CD161和CCR6來識別Th17細胞。Th17細胞的細胞標志物可以分為兩類:細胞內標志物和細胞外標志物。
細胞內標志物:IL-17A、IL-17F、IL-21、IL-22、RORα、RORγt、Stat-3。
細胞外標志物:CD3、CD4、CD38、CD161、CD194(CCR4)、CD196(CCR6)、IL-1R、TGF-β。
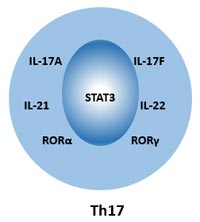
圖2. Th17細胞的細胞標記
3. Th17細胞分化調節
Th17細胞的分化受多種細胞因子和信號分子的調控。CD4+ T細胞在TGF-β和IL-6的協同作用下分化為Th17細胞。
CD4+ T細胞的激活的第一步是T細胞受體(TCR)的參與。TCR信號的強度決定了Th1/Th2分化的方向。然而,TCR信號對Th17細胞分化的影響尚不清楚。
不同因子對Th17細胞分化的調控效果各異。
轉化生長因子β(TGF-β)、IL-6、IL-23 [4]、IL-21和RORγt在Th17細胞分化和形成中發揮積極作用,而干擾素γ(IFN-γ)、IL-4和細胞因子信號3(Socs3)、Ets-1和IL-2則抑制其分化。
3.1 正向調節
Th17細胞的分化主要包括三個階段:誘導、擴增和穩定。
在初始分化階段,體內的初級CD4+ T細胞在TGF-β和IL-6的協同作用下分化為Th17細胞。IL-6 + TGF-β是其分化為Th17細胞的充分條件 [5]。
在這個階段,調控因子主要包括以下幾個:
● TGF-β
TGF-β在Treg細胞和Th17細胞分化中發揮重要作用。激活的初級CD4+ T細胞在僅TGF-β作用下分化為Foxp3+ Treg細胞;在TGF-β和IL-6的聯合誘導下分化為Th17細胞。
β通過上調IL-23受體(IL-23R)的表達水平來促進Th17細胞分化。TGF-β還促進了Forkhead box P3(Foxp3)和RORγt的表達。Foxp3抑制RORγt的表達。因此,當TGF-β濃度過高時,會誘導高水平的Foxp3表達,以拮抗轉錄因子RORγt的分化促進作用,從而抑制Th17細胞的分化 [6]。Foxp3的作用受到IL-6和IL-21的抑制。TGF-β、IL-6和IL-21等細胞因子通過復雜的調控機制完成Th17細胞的分化。
● IL-6
IL-6是一種重要的免疫調節因子,在各種免疫應答的早期階段發揮重要作用。IL-6可以直接作用于T細胞,通過gp130的酪氨酸殘基的信號傳導誘導STAT3激活。STAT3可以誘導Th17細胞特異性轉錄因子RORγt和RORα的表達,從而促進Th17細胞分化。
IL-6-gp130-STAT3通路是Th17細胞分化所必需的。阻斷IL-6-gp130-STAT3可能是控制由Th17細胞引起的自身免疫性疾病的有效措施。
此外,IL-6通過內源性TGF-β誘導IL-23R的表達和Th17細胞分化。在缺乏IL-6時,IL-21可以替代IL-6和TGF-β來誘導Th17細胞的分化 [7]并釋放IL-21。
● IL-9
IL-9是Th2產生的細胞因子。Th17細胞也表達IL-9。IL-9可以與TGF-β協同誘導Th17細胞分化,其誘導效率與TGF-β+IL-21誘導的Th17細胞分化類似。
● IL-1
IL-1在Th17細胞早期分化中發揮信號調控作用 [8]。在沒有外源性TGF-β的情況下,IL-1與IL-6和IL-23協同促進Th17細胞分化。IL-1R1在Th17細胞分化過程中的表達上調。IL-1R1的表達主要受到IL-6的影響,IL-23和TGF-β對IL-1R1的表達影響較小。IL-1R1的表達也依賴于STAT3、RORα和RORγt。
● IL-21
擴增階段主要由IL-21介導。細胞因子IL-21由Th17細胞自身分泌,可能通過自分泌來促進或維持Th17細胞的分化。IL-21的表達依賴于STAT3。STAT3可以直接結合分泌的IL-21啟動子,誘導Th17細胞再生產IL-21,并形成STAT3-Th17-IL-21自分泌環 [9]。IL-21可以通過IL-6誘導,并與IL-6一起上調IL-23受體的表達。IL-21不僅促進了Th17細胞的擴增,還維持了其表型的穩定性。
● IL-23
穩定階段主要由IL-23維持。盡管IL-23不參與Th17細胞的早期分化,但它是調節Th17細胞免疫功能的重要細胞因子,具有促進Th17細胞增殖和維持細胞亞群穩定性的功能。
在自身免疫性疾病的機制中,IL-23是促進Th17細胞引起的免疫病理損傷的重要效應因子,對諸如EAE和膠原關節炎等自身免疫疾病的誘導起重要作用。
IL-23與TGF-β、IL-6和IL-21一起上調Th17細胞表面的IL-23R的表達,并促進IL-17A、IL-17F和IL-22的產生。IL-23結合其受體并激活JAK-STAT信號通路,導致Jak2和Tyk2的磷酸化,從而促進信號轉導和轉錄激活子1(STAT1)、STAT3、STAT4和STAT5的磷酸化。
細胞因子IL-23也可能通過激活STAT3信號通路上調IL-17的表達 [10]。
IL-1也在Th17細胞的擴增和穩定中發揮重要作用。
● IRF4
IRF4(干擾素調節因子4)因子也是Th17細胞發展的關鍵成分。Brustle等人 [11]發現IRF4對Th17細胞分化具有積極影響。
● STAT3
STAT3的激活對于IL-6和IL-2調控Th17分化是必要的。
STAT3的缺失會導致Th17細胞特異性轉錄因子RORγt和RORα的表達顯著減少,而Foxp3的表達增加。Foxp3通過直接結合RORγt抑制RORγt介導的IL-17 mRNA轉錄,從而影響Th17細胞的功能 [12]。
當STAT3過度活躍時,RORγt的表達增加,從而抑制了Foxp3的表達,從而抑制了CD4+ T細胞分化為Treg細胞的過程,并促進Th17細胞的增殖。
此外,STAT3還可以增強Th17細胞對IL-23的響應能力,并通過SOCS3的抑制因子上調IL-17的表達。
● RORγt和RORα
RORγt(孤兒核受體γ t)是Th17細胞特異性轉錄因子。RORγt在Th17細胞分化過程中持續表達,并控制重要細胞因子如IL-17的表達。它誘導初級CD4+ T細胞分化為Th17細胞,IL-17的表達也依賴于其存在。與RORγt相比,RORα對于促進Th17細胞分化的能力較弱,似乎在Th17細胞的表達中發揮協同作用。
3.2 負向調節
● IL-27
IL-27是一種抑制Th17細胞分化的細胞因子,STAT1參與了這種抑制作用。IL-27的缺失會導致Th17細胞功能亢進,并在中樞神經系統中促進炎癥反應 [13]。
● IL-2
最近的研究發現IL-2是Th17細胞分化的抑制因子。IL-2抑制Th17分化的機制需要STAT5的參與 [14]。IL-2可以磷酸化STAT5并直接結合IL-17基因的啟動子,從而抑制IL-17的表達。此外,IL-2顯著降低了RORγt的表達。
● STAT1
STAT1抑制Th17細胞分化。一方面,STAT1通過上調SOCS3的表達減弱STAT3的活性;另一方面,STAT1通過抑制TGF-β介導的Smad轉錄活性來抑制Th17細胞分化。
● STAT5
目前的實驗顯示STAT5在Th17細胞分化上具有不同的作用。Yang等人 [15]發現過表達活化STAT5并不影響Th17細胞分化,而其他研究發現STAT5參與介導IL-2對Th17分化的抑制作用。
● Socs3
細胞因子信號抑制因子3(SOCS3)是一組在Th17細胞分化中抑制Janus激酶(JAK)和STAT信號轉導的蛋白質。它起到負調節作用。
SOCS3的作用機制:SOCS3限制STAT3的磷酸化,抑制STAT3與IL-17A/F啟動子的結合,從而抑制Th17細胞的產生。
IL-6和IL-21可以促進細胞因子信號抑制因子3(SOCS3)的表達。相反,TGF-β抑制SOCS3的表達。
● Ets-1
Moisan J等人 [16] 表明Ets-1是Th17細胞分化的負調節因子。Ets-1通過調控IL-2的表達來抑制Th17細胞的分化。
● IFN-γ
IFN-γ通過抑制Smad3的磷酸化阻斷TGF-β受體的作用,從而干擾TGF-β誘導的Th17細胞分化的過程。
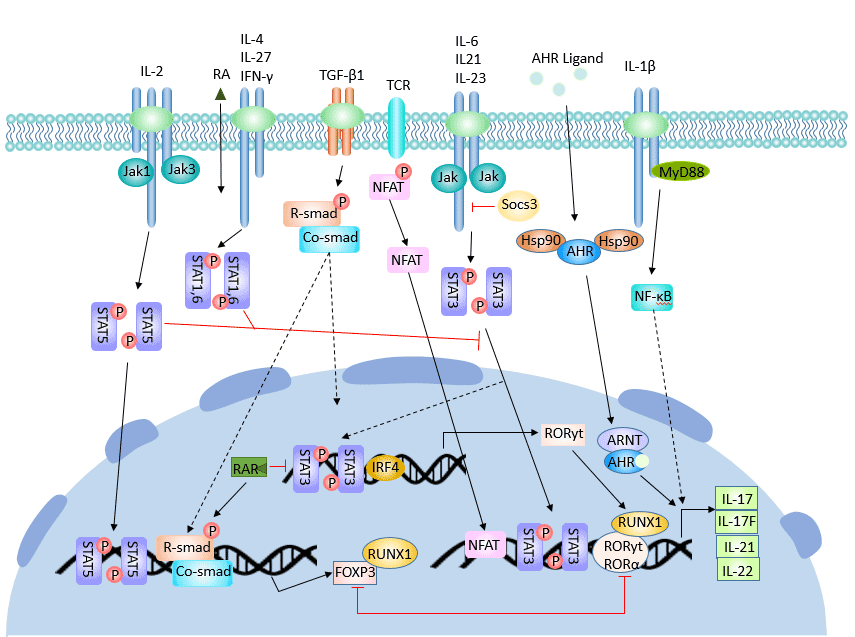
圖3. Th17細胞分化的調控過程
4. Th17細胞的生物學效應
Th17細胞主要通過分泌的細胞因子,如IL-17、IL-21、IL-22、IL-26和腫瘤壞死因子α(TNF-α),介導炎癥反應,在外源性病原體感染、腫瘤、移植排斥和自身免疫組織損傷的發展中發揮重要作用。
在Th17細胞分泌的細胞因子中,最重要的效應分子是IL-17。這個細胞因子家族包括6個IL-17成員(AF)和5個受體(IL-17RAIL-17RD和SEF)。
IL-17的主要生物學效應是促進炎癥反應,在宿主對抗細菌感染的免疫中扮演重要角色。
IL-17A的生理效應:在感染或炎癥的早期階段,IL-17A通過有效調節中性粒細胞參與促炎反應。
IL-17A可以誘導IL-6、急性期蛋白(APP)、粒細胞集落刺激因子(G-CSF)和前列腺素E2(PGE2)的表達,并與TNF-α一起增強促炎效應;IL-17A還增加了血管內皮細胞的生長,從而促進血管生成。
IL-17F和IL-17A在氨基酸水平上具有最高的同源性,并且在不同自身免疫疾病中也具有重疊的效應 [17]。
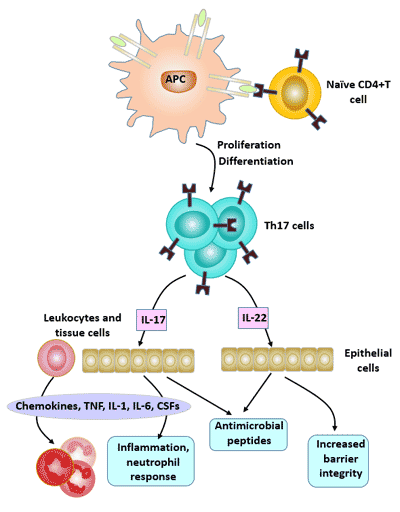
圖4. Th17細胞的生物學效應
5. Th17細胞與疾病
Th17細胞在自身免疫性疾病、傳染病和移植排斥中發揮重要的調節作用。大量研究表明,IL-17與實驗性自身免疫性腦炎(EAE)、哮喘和類風濕性關節炎(RA)等自身免疫性疾病密切相關。
5.1 Th17細胞與類風濕性關節炎
類風濕性關節炎(RA)是一種慢性自身免疫性疾病,其發病機制尚不清楚。在類風濕性關節炎的發生和發展中,Th17細胞的激活及其細胞因子起著關鍵作用 [18]。
CD4+ T細胞在受到IL-23刺激后能產生大量的IL-17。IL-17可以促進各種趨化因子的表達,進一步誘導中性粒細胞、巨噬細胞和淋巴細胞在滑膜組織中積聚。隨后,致病性T細胞的分化、增殖和功能穩定性引起滑膜組織增生和滑膜降解酶的分泌,最終導致類風濕性關節炎患者的滑膜炎癥。
5.2 Th17與傳染病
Th17細胞是炎癥的重要效應細胞和靶細胞,在慢性炎癥過程中發揮重要作用。體內Th17/Treg平衡是感染發生和感染嚴重性的重要調節機制。Th17細胞是參與傳染病的重要淋巴細胞。
細胞因子IL-23能誘導Th17的發展,并促使其分泌其他因子(如IL-17、IL-6、IL-8等)。
5.3 Th17與腫瘤
大部分研究表明Th17細胞可能促進腫瘤的發展 [19]。研究發現 [20],IL-17能促進小鼠體內的腫瘤生長。然而,一些研究則暗示Th17細胞可能抑制腫瘤的發展 [21]。
參考文獻:
[1] Park H, Li Z, Yang X O, et al. A distinct lineage of CD4 T cells regulates tissue inflammation by producing interleukin 17 [J]. Nature Immunology, 2005, 6(11): 1133-1141.
[2] Harrington L E, Hatton R D, Mangan P R, et al. Interleukin 17-producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages [J]. Nature Immunology, 2005, 6(11): 1123-1132.
[3] Cua D J, Sherlock J, Chen Y, et al. Interleukin-23 rather than interleukin-12 is the critical cytokine for autoimmune inflammation of the brain [J]. Nature, 2003, 421(6924): 744-748.
[4] Croxford A L, Mair F, Becher B. IL-23: One cytokine in control of autoimmunity [J]. European Journal of Immunology, 2012, 42(9): 2263-2273.
[5] Carrier Y, Gao W, Korn T, et al. Reciprocal developmental pathways for the generation of pathogenic effector TH17 and regulatory T cells [J]. Nature (London), 2006, 441(7090): 235-238.
[6] Zhou L, Lopes J E, Chong M M, et al. TGF-beta-induced Foxp3 inhibits T(H)17 cell differentiation by antagonizing ROR gamma t function [J]. Nature, 2008, 453(7192): 236-40.
[7] Monteleone G, Pallone F, Macdonald T T. Interleukin-21: a critical regulator of the balance between effector and regulatory T-cell responses [J]. Trends in Immunology, 2008, 29(6): 0-294.
[8] Chung Y, Chang S H, Martinez G J, et al. Critical Regulation of Early Th17 Cell Differentiation by Interleukin-1 Signaling [J]. Immunity, 2009, 30(4): 576-587.
[9] Wei L, Laurence A, Elias K M, et al. IL-21 Is Produced by Th17 Cells and Drives IL-17 Production in a STAT3-dependent Manner [J]. Journal of Biological Chemistry, 2007, 282(48): 34605-34610.
[10] Mathur A N, Chang H C, Zisoulis D G, et al. Stat3 and Stat4 Direct Development of IL-17-Secreting Th Cells [J]. The Journal of Immunology, 2007, 178(8): 4901-4907.
[11] Floess S, Freyer J, Siewert C, et al. Epigenetic Control of the foxp3 Locus in Regulatory T Cells [J]. PLoS Biology, 2007, 5(2): e38.
[12] Ichiyama K, Yoshida H, Wakabayashi Y, et al. Foxp3 inhibits ROR gamma t-mediated IL-17A mRNA transcription through direct interaction with RORgammat [J]. Journal of Biological Chemistry, 2008, 283(25): 17003-17008.
[13] Tone Y, Furuuchi K, Kojima Y, et al. Smad3 and NFAT cooperate to induce Foxp3 expression through its enhancer [J]. Nature Immunology, 2008, 9(2): 194-202.
[14] Cobb B S, Hertweck A, Smith J, et al. A role for Dicer in immune regulation [J]. Journal of Experimental Medicine, 2006, 203(11): 2519-2527.
[15] Li B, Carey M, Workman J L. The Role of Chromatin during Transcription [J]. Cell, 2007, 128(4): 0-719.
[16] Moisan J, Grenningloh R, Bettelli E, et al. Ets-1 is a negative regulator of Th17 differentiation [J]. Journal of Experimental Medicine, 2007, 204(12): 2825-2835.
[17] Chaudhari S S, Moussian B, Specht C A, et al. Functional Specialization Among Members Of Knickkopf Family Of Proteins In Insect Cuticle Organization [J]. Plos Genetics, 2014, 10(8): e1004537.
[18] Leipe J, Grunke M, Dechant C, et al. Role of Th17 cells in human autoimmune arthritis [J]. Arthritis & Rheumatism, 2014, 62(10): 2876-2885.
[19] Iwahashi. Tumor-infiltrating CD4+ Th17 cells produce IL-17 in tumor microenvironment and promote tumor progression in human gastric cancer [J]. Oncology Reports, 2011, 25(5).
[20] Numasaki M, Fukushi J I, Ono M, et al. Interleukin-17 promotes angiogenesis and tumor growth [J]. Blood, 2003, 101(7): 2620-2627.
[21] Yang L J, Qi Y X, Hu J, et al. Expression of Th17 Cells in Breast Cancer Tissue and Its Association with Clinical Parameters [J]. Cell Biochemistry & Biophysics, 2012, 62(1): 153-159.
上一篇: Th1和Th2細胞如何分化?
下一篇: Treg細胞的鑒別










