MAGEA4:黑色素瘤相關抗原(MAGE)家族成員,腫瘤特異性免疫研究熱門靶點!
日期:2023-11-08 13:17:40
加拿大生物公司AbCellera在AACR 2023年年會上展示了針對MAGE-A4的T細胞誘導劑(TCE)平臺的最新數據。TCE是一種雙特異性抗體,能夠同時結合腫瘤殺傷性T細胞和腫瘤靶點,引導免疫系統識別并消除癌細胞。AbCellera詳細描述了針對一種經過驗證的肽-主要組織相容性復合物(pMHC)腫瘤靶點的高特異性和可開發性抗體的發現。通過充分利用TCE針對攜帶腫瘤特異性抗原的pMHC,可以激活對這一通常難以靶向的MAGE-A4腫瘤靶點的免疫效應。
黑色素瘤相關抗原4(MAGE-A4)屬于MAGE-As亞家族成員。MAGE-As在一系列惡性腫瘤中廣泛表達,顯示了腫瘤靶向免疫研究的巨大潛力。目前,MAGE-A亞家族中研究最為深入的是MAGE-A1和MAGE-A3,對于其它成員的研究還較少。因MAGE-As蛋白具有很強的抗原同源性,特異性較弱,較難獲得特異性抗體。這給MAGE-A亞家族蛋白表達的研究帶來了困難。目前,許多學者已經開始研制特異性更強的單克隆抗體,進一步探索MAGE家族蛋白在腫瘤特異性免疫研究中的價值!
1. 什么是黑色素瘤相關抗原(MAGE)?
黑色素瘤相關抗原(Melanoma antigen,MAGE)家族是一個復雜的大家庭,分為兩個亞類,即MAGE-I類和MAGE-II類 (圖1) [1]。MAGE-I類抗原為腫瘤特異性抗原(Tumor-Specific Antigen,TSA),屬于癌睪丸抗原中的一個大家族,主要分布在生殖細胞和滋養細胞上,包括MAGE-A、B和C三個亞家族。MAGE-II類抗原,在人體正常的細胞中可見其表達,成員有MAGE-D、E、F、G、H及L等亞科,其不屬于癌睪丸抗原的范疇。其中,MAGE-As家族包括MAGE-A1~MAGE-A15共15個成員,人類許多其它組織來源的腫瘤都至少表達一種MAGE-A基因。因此,MAGE-A作為一種腫瘤特異性的抗原得到廣泛關注,已成為多種腫瘤靶向免疫的重要靶點 [1-5]。
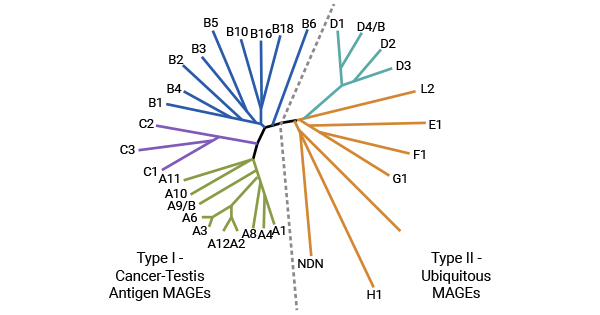
圖1. 黑色素瘤相關抗原MAGE家族 [1]
2. 什么是MAGE-A4?
黑色素相關抗原A4(Melanoma-associated antigen 4,簡稱MAGEA4或MAGE-A、MAGE4)是一種腫瘤/睪丸組織中抗原,屬于MAGE-As蛋白家族亞型。MAGE-As亞家族主要位于X染色體q28區域,長約45kb,有3個外顯子,其中第1、2號外顯子很短,第3號外顯子較長。MAGE-A編碼一個309-319個氨基酸的蛋白質(圖2) [1]。MAGE-A在細胞內可被加工成抗原肽,與HLA-I類分子相結合形成復合物,通過MHC I類分子提呈給CD8+T細胞,在腫瘤患者體內誘發腫瘤特異性免疫應答。目前,MAGE-As亞家族蛋白水平的研究相對于基因水平的研究較少 [6-8]。
MAGE-A4在正常組織中僅在睪丸和胎盤表達,但在多種癌癥細胞中廣泛存在。MAGE家族是首個發現的癌胚抗原,激發了針對腫瘤細胞的特異性免疫研究,其中MAGE-A亞家族研究最為廣泛。研究表明MAGE-A基因可以激活特異性T淋巴細胞,促使其攻擊腫瘤細胞。而超過一半的腫瘤表達MAGE基因,因此,研究MAGE-A家族對于腫瘤的免疫研究具有重要意義 [9-11]。
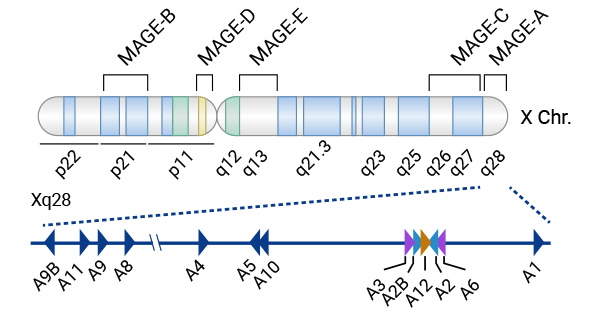
圖2. MAGE-As亞家族主要位于X染色體q28區域 [1]
3. MAGE-A4在腫瘤中的相關調控機制
MAGE-A4所表現出與家族其他成員不同的生物學特,MAGE-A4具有以下特點而被優先當做腫瘤疫苗的靶抗原:(1)它含有的肽段可以與特定的MHC分子相結合;(2)肽MHC與MAGE-A4所形成的復合物,可以與特定的T細胞受體結合并促進并激活特異性T細胞殺傷腫瘤細胞。目前對MAGE-A4的研究較少,MAGE-A4在腫瘤中的調控機制,很大程度上仍然是個未知數,但是越來越多的證據暗示了MAGE-A4參與了細胞凋亡和細胞周期進程 [11-19]。
研究發現,MAGE-A4與抑癌基因P53呈正相關,其C端107個氨基酸片段(MAGE-A4DeltaN1)通過與Miz-1部分結合可誘導P53-依賴和P53-非依賴的獨立機制,增強了P53的轉錄活性,但是減少了p21(Cip1)轉錄子和蛋白水平。p53基因是重要的抑癌基因,可促使癌細胞凋亡并控制細胞周期。因此,MAGE-A4蛋白表現出的抑制腫瘤進展的生物學活性,提示該蛋白可以保護機體免受腫瘤的攻擊(圖3) [13]。同時也有研究提示Twist1的增強子與MAGE-A4的啟動子以非直接方式結合,從而使MAGE-A4擴增。然而,另外的研究提示MAGE-A4可以活化跨損傷DNA合成(Trans-lesion synthesis,TLS)途徑的活化,抑制對正常細胞的損傷修復,而選擇性活化化療細胞DNA損傷修復,造成腫瘤細胞損傷的修復,從而引起腫瘤細胞對化療藥的耐藥 [11]。
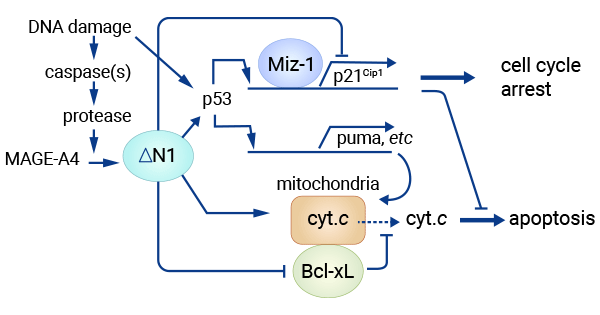
圖3. MAGE-A4和Miz-1部分結合可誘導P53-依賴和P53-非依賴的獨立機制 [13]
4. MAGE-A4在腫瘤中的作用
MAGE-A家族成員表達于多種類型的腫瘤組織,如肝癌、非小細胞肺癌、膀胱癌、外陰癌、結直腸腫瘤、唾液腺腫瘤、宮頸癌等 [4-5,20-21]。最近的研究結果證實了MAGE-A4在乳腺癌、膠質瘤、食管鱗癌、前列腺癌、甲狀腺癌以及口腔鱗狀細胞癌等多種惡性腫瘤中的表達 [10-11,22-23]。這一廣泛的分布提示了MAGE-A4在多種腫瘤類型中可能具有重要的生物學功能和臨床意義。
4.1 MAGE-A4和乳腺癌研究
研究發現,在三陰性乳腺癌(TNBC)中,MAGE-A4的陽性率為35.21%,高于非三陰性乳腺癌。此外,研究指出MAGE-A4表達與腫瘤臨床分期相關,隨著臨床分期升高,其陽性表達率下降,可能在腫瘤進展中發揮抑制作用。MAGE-A家族成員和NY-ESO-1在乳腺癌中被確認為腫瘤相關抗原,與雌激素受體(ER)的表達呈正相關。同時,MAGE-As的表達與乳腺癌不良預后指標HER-2呈正相關。此外,MAGE-A4能夠激活體內CD4+T細胞,促進機體免疫反應,有可能在腫瘤早期通過免疫反應殺死腫瘤細胞。這些研究結果表明MAGE-A4有望成為TNBC的潛在靶點 [22]。
4.2 MAGE-A4和膠質瘤研究
研究發現MAGE-A4在膠質瘤中表達與正常腦組織相比差異有統計學意義。MAGE-A4具有在睪丸組織之外正常體細胞不表達的特點,這為MAGE-A4作為特異性靶抗原應用到膠質瘤免疫研究提供了理論依據。MAGE-A4 mRNA在高級別膠質瘤(Ⅲ~Ⅳ級)中表達明顯高于低級別膠質瘤(Ⅰ~Ⅱ級),這表明MAGE-A4可能與膠質瘤惡性分化相關,可作為評估惡性程度的參考指標,或用于評估膠質瘤患者的KPS評分和病理分級。MAGE-A4在腦膠質瘤組織中有特異性表達,并且與病理級別顯著相關,而在正常腦組織中沒有表達。因此,MAGE-A4可以作為腦膠質瘤免疫研究的理想靶點 [23, 25]。
4.3 MAGE-A4和食管鱗癌研究
實驗采用qPCR和免疫組化的方法分別檢測,研究人員發現在食管鱗癌中,MAGE-A4的表達率高達50%,而在不典型組織和正常食管黏膜中表達水平較低。這一發現不僅突顯了MAGE-A4基因在食管鱗癌中的嚴格腫瘤表達特異性,而且證實了其在食管鱗癌發展中的潛在作用。因此,MAGE-A4基因可以作為食管鱗癌特異性標志物,為準確臨床研究提供了有力依據。隨著腫瘤特異性標志物在臨床中的逐步應用,其對大多數惡性腫瘤的效果產生積極影響,為后續臨床研究提供有效支持 [27-28]。
4.4 MAGE-A4和其它腫瘤研究
研究表明MAGE-A4在多種腫瘤中發揮重要作用。例如,利用小RNA使肺鱗癌細胞系H1703中的MAGE-A4基因表達沉默后,caspase-3活性下降了58% [28]。另一項研究針對直腸癌患者展示了MAGE-A4抗原肽治療的有效性,導致患者腫瘤生長速度及癌胚抗原顯著降低 [29]。此外,針對187例非小細胞肺癌患者的研究表明,組織中MAGE-A4的表達可能導致人白細胞抗原HLA的丟失,進而導致患者的5年生存率顯著下降 [30]。在食管癌組織中,MAGE-4,MAGE-12和NY-ESO-1呈現不同程度的表達,而在食管癌旁的正常組織中則不表達 [31]。此外,MAGE-A與前列腺癌中的AR形成分子橋,促進AR的轉錄活性,進而促進AR依賴性前列腺癌的生長 [4, 32]。
5. MAGE-A4臨床研究前景
目前,有19種針對MAGEA4的藥物在臨床研究中,其中最高階段的是Afamitresgene Autoleucel(艾基奧侖賽),一種TCR細胞療法,已經進入三期臨床試驗,用于治療滑膜肉瘤,食管癌和粘液樣脂肪肉瘤等。其他藥物的類型包括雙特異性抗體,重組蛋白,細胞療法,融合蛋白和T細胞療法等。這些藥物的共同靶點是MAGE-A4,部分藥物還針對其他靶點,如CD3,MAGEA8,NY-ESO-1,PRAME,SSX2,survivin,WT1,HLA-A 24,CCL19,IL-7等。
基于MAGEA4靶點的藥物作用機制主要是通過調節或抑制MAGEA4或其他靶點的表達或功能,來誘導腫瘤細胞的凋亡或抑制腫瘤的生長和轉移。部分藥物還通過增強免疫系統的反應或替代損傷的細胞來發揮作用。這些藥物的在研適應癥主要是各種類型的腫瘤,如黑色素瘤,膀胱癌,非小細胞肺癌,頭頸部腫瘤等。部分藥物還有其他在研適應癥,如血液及淋巴系統疾病,消化系統疾病,呼吸系統疾病等。MAGEA4靶點藥物的研發展示了其活躍性和多樣性,也凸顯了該靶點在腫瘤免疫研究中的重要地位和前景。
為鼎力協助科研和藥企人員針對MAGEA4的在腫瘤中的臨床應用研究,CUSABIO推出MAGEA4活性蛋白(Code:CSB-MP013330HU)以及MAGEA4抗體(Code: CSB-MA013330A0m),助力您在MAGEA4機制方面的研究或其潛在臨床價值的探索。
華美 CUSABIO MAGEA4 蛋白
Recombinant Human Melanoma-associated antigen 4 (MAGEA4) (Active) Code: CSB-MP013330HU
The high purity is greater than 90% as determined by SDS-PAGE.
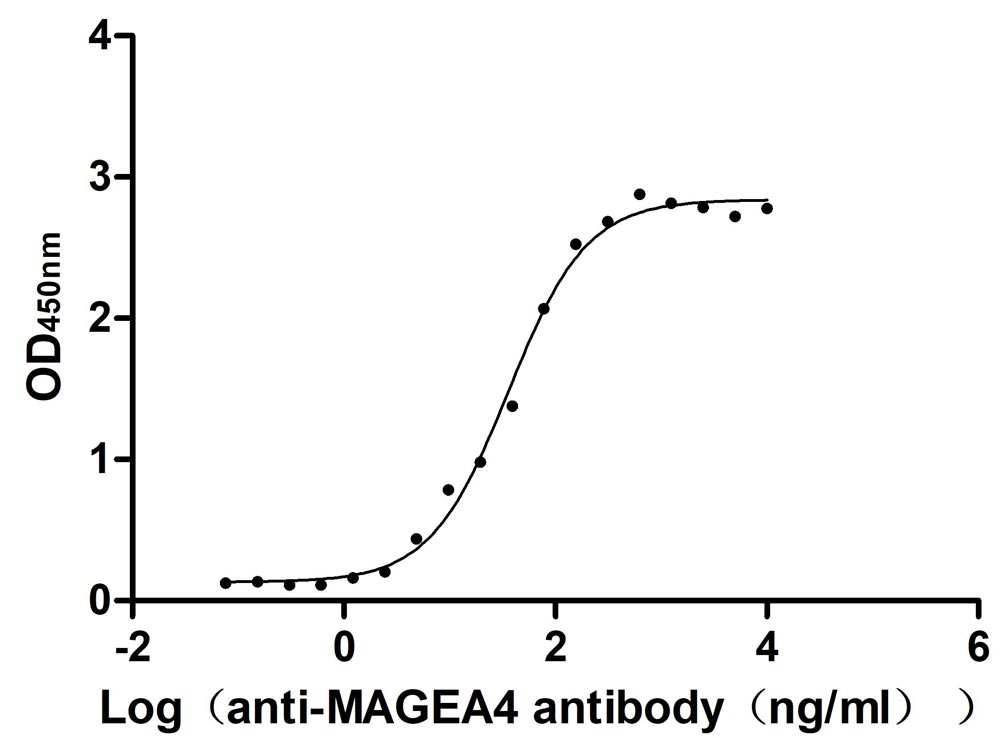
Immobilized Human MAGEA4 at 2 μg/ml can bind anti-MAGEA4 recombinant antibody. The EC50 is 30.33-43.10 ng/mL.
華美 CUSABIO MAGEA4 抗體
參考文獻:
[1] Lee, Anna K., and Patrick Ryan Potts. "A comprehensive guide to the MAGE family of ubiquitin ligases." Journal of molecular biology 429.8 (2017): 1114-1142.
[2] Chomez, Patrick, et al. "An overview of the MAGE gene family with the identification of all human members of the family." Cancer research 61.14 (2001): 5544-5551.
[3] Weon, Jenny L., and Patrick Ryan Potts. "The MAGE protein family and cancer." Current opinion in cell biology 37 (2015): 1-8.
[4] Meek, David W., and Lynnette Marcar. "MAGE-A antigens as targets in tumour therapy." Cancer letters 324.2 (2012): 126-132.
[5] Sang, Meixiang, et al. "MAGE-A family: attractive targets for cancer immunotherapy." Vaccine 29.47 (2011): 8496-8500.
[6] Aubry, Florence, et al. "MAGE‐A4, a germ cell specific marker, is expressed differentially in testicular tumors." Cancer: Interdisciplinary International Journal of the American Cancer Society 92.11 (2001): 2778-2785.
[7] Hagiwara, Yoshio, et al. "Consequences of point mutations in melanoma-associated antigen 4 (MAGE-A4) protein: Insights from structural and biophysical studies." Scientific reports 6.1 (2016): 25182.
[8] Sun, Qian, et al. "T-cell receptor gene therapy targeting melanoma-associated antigen-A4 by silencing of endogenous TCR inhibits tumor growth in mice and human." Cell death & disease 10.7 (2019): 475.
[9] Chambost, Hervé, et al. "Expression of gene MAGE-A4 in Reed-Sternberg cells." Blood, The Journal of the American Society of Hematology 95.11 (2000): 3530-3533.
[10] Kocher, Thomas, et al. "Prognostic relevance of MAGE‐A4 tumor antigen expression in transitional cell carcinoma of the urinary bladder: a tissue microarray study." International journal of cancer 100.6 (2002): 702-705.
[11] Gao, Yanzhe, et al. "A neomorphic cancer cell-specific role of MAGE-A4 in trans-lesion synthesis." Nature communications 7.1 (2016): 12105.
[12] Saito, Takuro, et al. "High expression of MAGE-A4 and MHC class I antigens in tumor cells and induction of MAGE-A4 immune responses are prognostic markers of CHP-MAGE-A4 cancer vaccine." Vaccine 32.45 (2014): 5901-5907.
[13] Sakurai, Toshiharu, et al. "A cleaved form of MAGE-A4 binds to Miz-1 and induces apoptosis in human cells." Journal of Biological Chemistry 279.15 (2004): 15505-15514.
[14] Cruz, Conrad R., et al. "Improving T-cell therapy for relapsed EBV-negative Hodgkin lymphoma by targeting upregulated MAGE-A4." Clinical Cancer Research 17.22 (2011): 7058-7066.
[15] Sanderson, Joseph P., et al. "Preclinical evaluation of an affinity-enhanced MAGE-A4-specific T-cell receptor for adoptive T-cell therapy." Oncoimmunology 9.1 (2020): 1682381.
[16] Takahashi, Norihiko, et al. "First clinical trial of cancer vaccine therapy with artificially synthesized helper/killer‐hybrid epitope long peptide of MAGE‐A4 cancer antigen." Cancer science 103.1 (2012): 150-153.
[17] Kageyama, Shinichi, et al. "Adoptive transfer of MAGE-A4 T-cell receptor gene-transduced lymphocytes in patients with recurrent esophageal cancer." Clinical Cancer Research 21.10 (2015): 2268-2277.
[18] Okumura, Satoshi, et al. "Chimeric antigen receptor T-cell therapy targeting a MAGE A4 peptide and HLA-A* 02: 01 complex for unresectable advanced or recurrent solid cancer: protocol for a multi-institutional phase 1 clinical trial." BMJ open 12.11 (2022): e065109.
[19] Kobayashi, Hiroshi, et al. "The biology of uterine sarcomas: a review and update." Molecular and clinical oncology 1.4 (2013): 599-609.
[20] Tsai, Jong-Rung, et al. "Differential expression profile of MAGE family in non-small-cell lung cancer." Lung cancer 56.2 (2007): 185-192.
[21] Dhodapkar, Madhav V., et al. "Expression of cancer/testis (CT) antigens MAGE-A1, MAGE-A3, MAGE-A4, CT-7, and NY-ESO-1 in malignant gammopathies is heterogeneous and correlates with site, stage and risk status of disease." Cancer Immunity 3.1 (2003).
[22] Cabezon, Teresa, et al. "Proteomic profiling of triple-negative breast carcinomas in combination with a three-tier orthogonal technology approach identifies Mage-A4 as potential therapeutic target in estrogen receptor negative breast cancer." Molecular & Cellular Proteomics 12.2 (2013): 381-394.
[23] Two-Pronged, A. "471. CMV-Specific HER2-Redirected T Cells for the Adoptive Immunotherapy of Glioblastoma." Molecular Therapy 18 (2010): 1.
[24] Guo, Liru, et al. "The expression and clinical significance of melanoma?associated antigen?A1,?A3 and?A11 in glioma." Oncology letters 6.1 (2013): 55-62.
[25] Ebrahimabadi, S., et al. "MAGE-A4-CAR-NK CELL THERAPY FOR THE TREATMENT OF SOLID TUMORS." Hematology, Transfusion and Cell Therapy 45 (2023): S534-S535.
[26] Chen, Xiaohua, et al. "Analysis of the function of MAGE-A in esophageal carcinoma by bioinformatics." Medicine 98.21 (2019).
[27] Ueda, Shugo, et al. "NY-ESO-1 antigen expression and immune response are associated with poor prognosis in MAGE-A4-vaccinated patients with esophageal or head/neck squamous cell carcinoma." Oncotarget 9.89 (2018): 35997.
[28] Peikert, Tobias, et al. "Melanoma antigen A4 is expressed in non–small cell lung cancers and promotes apoptosis." Cancer research 66.9 (2006): 4693-4700.
[29] Liu, Fangfang, et al. "A study of protein expression of MAGE-A3, MAGE-A4 and MAGE-A10 genes in colorectal carcinoma and its clinical significance." Chinese Journal of General Surgery (2012): 37-39.
[30] Baba, Tetsuro, et al. "Clinical significance of human leukocyte antigen loss and melanoma-associated antigen 4 expression in smokers of non-small cell lung cancer patients." International journal of clinical oncology 18 (2013): 997-1004.
[31] Zhang, Yujie, Yuxin Zhang, and Li Zhang. "Expression of cancer–testis antigens in esophageal cancer and their progress in immunotherapy." Journal of cancer research and clinical oncology 145 (2019): 281-291.
[32] Bergeron, Alain, et al. "High frequency of MAGE‐A4 and MAGE‐A9 expression in high‐risk bladder cancer." International Journal of Cancer 125.6 (2009): 1365-1371.










