滋養層糖蛋白TPBG:雙功能癌胚抗原,腫瘤ADC或疫苗新靶點!
日期:2023-02-01 10:15:09
近日,滋養層糖蛋白TPBG引起多家藥企的廣泛興趣。來自ClinicalTrials臨床的數據顯示,針對TPBG靶點已有10多種藥物在研。其中,靶向TPBG的癌胚抗原瘤苗(Trovax)進展最快,已先后完成了多種不同腫瘤臨床二期和三期試驗。多款ADC藥物的臨床數據也陸續披露,例如,Asana BioSciences公司scFv-Fc抗體偶聯藥物(ASN004)可選擇性地結合到表達TPBG的癌細胞上并被其內化,臨床前研究顯示,ASN004在多種腫瘤異種移植小鼠模型中能夠誘導腫瘤消退。Byondis BV公司的靶向TPBG抗體(SYD1875),其相關報道揭示,SYD1875不僅能夠實現靶向殺傷,也能夠誘導旁觀者效應介導的抗腫瘤活性。事實上,大量研究已揭示TPBG是一種雙重功能的癌胚抗原,既對胚胎生長發育不可或缺,又對腫瘤發生發展有促進作用,使其成為腫瘤免疫治療機會靶點!
1. TPBG的結構
滋養層糖蛋白TPBG(Trophoblast glycoprotein,又稱5T4或WAIF1)是發現于胚胎滋養層細胞的糖蛋白。TPBG基因位于人6號染色體的p臂(6p14-15),屬一種N端高度糖基化跨膜糖蛋白,TPBG蛋白的分子量約為72kDa,含420個氨基酸,其中細胞外部分由310個氨基酸組成,跨膜區含20個氨基酸,細胞質內由44個氨基酸組成,含PDZ結構,可重構細胞骨架,改變細胞膜的完整性。細胞外氨基酸部分有7個N糖基化位點,其結構具有多樣性,能夠防止蛋白質水解。TPBG糖蛋白還有7個富亮氨酸重復序列(leucine-rich repeat,LRR),參與蛋白質之間的相互作用 (圖1) [1]。人類和小鼠的TPBG序列相比較,兩個物種之間是高度保守的,跨膜區域和胞質部分的氨基酸一致性水平達到81%。大量的證據顯示TPBG與不同的生理、病理過程密切相關,如細胞間連接、細胞形態及運動、細胞黏附能力、細胞膜的完整性等等 [2]。
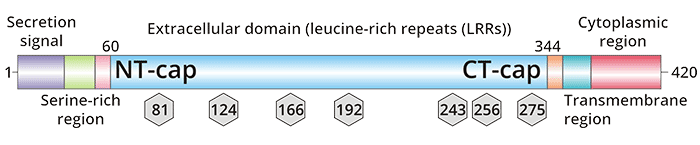
圖1. TPBG的結構 [6]
2. TPBG的表達及功能
TPBG在胚胎發育時期,相對廣泛表達,在整個懷孕過程中TPBG強烈表達在胎盤滋養層細胞中,而正常組織僅在某些特殊的上皮中存在,如基底層復層鱗狀上皮、腺體和導管上皮,以及視網膜次級神經元和嗅球。TPBG不僅僅在胚胎細胞發育、著床與植入等過程中起到重要作用,而且可以在胚胎期引導細胞分化和胚胎器官生成 [3, 4]。
在腫瘤相關的研究中,學者們發現正常人滋養層細胞和惡性腫瘤細胞有著共同的生理或病理過程,包括侵入局部組織和逃避免疫監視。陸續的研究表明,TPBG在多種實體腫瘤組織中有較高表達,而正常的成熟組織中卻很少存在,被認為是一種腫瘤相關性抗原,成為抗癌藥的重要設計靶點。也就是說,TPBG不僅對胚胎生長發育至關重要,而且可能促進腫瘤細胞,擁有與滋養層細胞相似的局部浸潤和逃避免疫監視的能力 [4]。
3. TPBG的腫瘤調節機制
目前,關于TPBG的研究在腫瘤發生發展過程中的信號通路以及分子機制尚未明確,現有的研究表明,TPBG可能通過這三個機制發揮作用:1)上皮-間質轉化(EMT);2)CXCL12/CXCR4生物軸的調節;3)Wnt信號轉導 [5]。
3.1 TPBG和上皮細胞-間質轉化(EMT)
上皮細胞-間充質轉化(EMT),是上皮細胞通過特定程序轉化為具有間質表型細胞的生物學過程。已有許多證據表明,EMT在腫瘤發生浸潤和轉移中扮演著重要角色。而EMT最重要特征之一是E-cadherin的表達下調,其可促進癌細胞的遷移。E-cadherin通過與胞質內的β-catenin結合形成E-cadherin/β-catenin復合體,此復合體與肌動蛋白細胞骨架結合,保證細胞的黏附和極性形成 [5, 6]。
通過對鼠胚胎干細胞表面的TPBG抗原研究揭示,敲除TPBG的鼠胚胎干細胞,表現出明顯的活動力下降、遷移能力減弱;增強小鼠上皮細胞TPBG cDNA表達,可誘導E-cadherin轉化為N鈣粘蛋白(N-cadherin),E-cadherin抑制因子Snail和Slug蛋白上調,從而造成E-cadherin蛋白減少,同時還發現細胞膠原酶活性增加(如基質金屬蛋白酶MMP-2和MMP-9)。也就是說,TPBG可誘導E-cadherin下調,導致細胞骨架肌動蛋白的重組,及細胞黏附的減弱,造成細胞形態的改變及細胞遷移的增強。因此,TPBG是調節細胞發生EMT的關鍵分子之一,影響腫瘤的發生發展 [5, 6]。
3.2 TPBG和CXCR4/CXCL12生物軸
TPBG與CXCR4/CXCL12生物軸的關系,是在發現抗mTPBG抗體能抑制CXCL12對分化的鼠胚胎干細胞的趨化作用后,而備受關注的。CCXL12是一種由基質細胞產生的趨化因子,其受體為CXCR4,二者結合形成了著名的CXCR4/CXCL12軸,有啟動細胞信號傳導并啟動細胞趨化作用的能力,與腫瘤的發生、侵襲、轉移密切相關 (點擊查看關于細胞因子專題報道)。
研究人員發現,在敲除TPBG的小鼠體內的鼠胚胎干細胞(ES細胞)和胚胎成纖維細胞(MEF細胞)中,僅CXCR4表達,細胞趨化性丟失。用編碼TPBG蛋白的腺病毒轉染小鼠的ES細胞和MEF細胞,可恢復CXCR4和TPBG的膜共定位表達,以及CXCL12的趨化性,證實TPBG能激活CXCR4的細胞表面定位和趨化性 [5, 7]。
此外,在TPBG表達缺失時,CXCL12與CXCR4結合受阻,游離的CXCL12又可與CXCR7結合,激活Ras-Raf-MAPK和P13K-Akt兩條轉導通路,促進腫瘤的生長增殖。因此,TPBG通過CXCR4/CXCL12軸,促進腫瘤細胞的趨化轉移,或再進一步選擇性表達CXCR7,通過CXCR7/CXCL12軸促進腫瘤細胞的增殖 [4, 5, 7]。
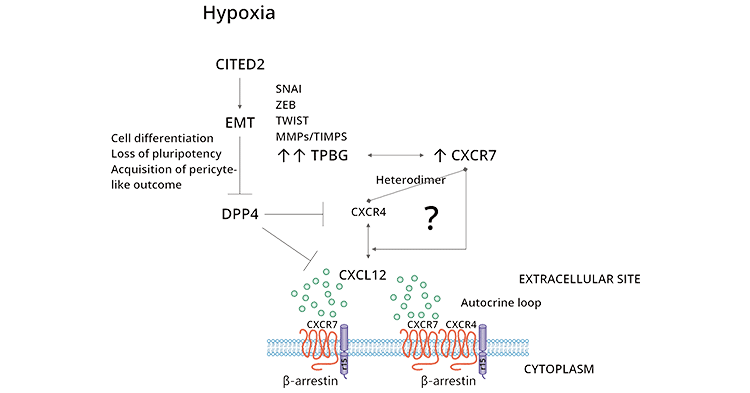
圖2. TPBG相關的信號通路 [4]
3.3 TPBG和Wnt信號轉導
TPBG有調節Wnt信號轉導功能的能力,但TPBG對Wnt信號體系的調節是雙面的:一方面TPBG阻斷經典Wnt/β-catenin信號通路;另一方面TPBG又通過激活非經典Wnt信號通路,不需β-catenin通路的激活。Wnt信號通路在正常成熟的細胞中處于關閉狀態,但在腫瘤細胞中信號活性增高,目前已在人多種腫瘤中發現Wnt信號通路的激活 [5, 9]。
研究發現,在乳腺癌、胃癌、黑色素瘤中,TPBG可通過DKK1蛋白使Wnt輔助受體LRP5/6產生變構,從而抑制Frizzled-LRP5/6的生成,阻止LRP5/6的信號放大,阻斷經典的Wnt信號,從而阻礙細胞正常的發育和分化。另一方面,TPBG又通過DKKl蛋白激活非經典Wnt信號通路,通過激活JNK基因,促進細胞骨架重組,增強細胞運動能力,導致癌細胞擴散,使患者臨床存活能力下降 [5, 9]。
4. TPBG在腫瘤中的作用
TPBG作為一種細胞表面癌胚抗原,現有研究揭示,TPBG在人體多種腫瘤中存在選擇性高表達,如在結腸癌、胃癌、腎癌、宮頸癌、卵巢癌等等。TPBG既在基底細胞中有保留性地出現,又在腫瘤細胞中高調表達;既能促進上皮細胞間質化分化,又能加快腫瘤細胞浸潤轉移。因此,TPBG與腫瘤的關系引起廣泛的關注。
在結直腸癌和胃癌中,研究顯示TPBG表達與腫瘤轉移高度相關,且發現在腫瘤的早期階段TPBG陽性多出現于基底層細胞。此外,對72例結腸癌病人的TPBG抗原表型與患者的預后進行分析,有56%的腫瘤細胞TPBG表達陽性。TPBG表達陽性的腫瘤患者五年生存率為22%,而TPBG表達陰性的病人五年生存率增加到75% [9]。來自英國Oxford BioMedica公司開發的一款靶向TPBG的癌癥基因疫苗(藥名MVA-5T4或Trovax)首次應用于轉移性結直腸癌(mCRC)的臨床實驗表明,MVA-5T4耐受性良好,沒有嚴重的不良反應 [10]。
在前列腺癌中,免疫組化分析發現TPBG在正常前列腺組織中極少表達,在良性前列腺增生組織中有散在低水平表達,且多位于局部的基底細胞,而在前列腺癌細胞中表達明顯增加,TPBG陽性細胞大多數在前列腺癌腺管上皮。Trovax也在前列腺癌患者中進行了臨床研究,主要對比單獨用Trovax或Trovax聯合粒細胞-巨噬細胞集落刺激因子(Granulocyte-macrophage colony-stimulating factor,GM-CSF)的臨床效果,其未出現嚴重的毒性反應,相比連用GM-CSF組,TroVax組患者的疾病進展期延長 [11]。
在腎癌中,對72例腎透明細胞癌的TPBG和CXCR4共表達統計分析,TPBG與腎透明細胞病理分級和臨床分期都呈正相關,免疫熒光同步顯示了TPBG與CXCR4的共表達定位。MVA-5T4也在治療轉移性腎癌中進行了不同的臨床試驗,結果表明MVA-5T4接種后誘導的5T4/TPBG抗體反應與癌癥患者的預后情況相關,癌癥患者5T4/TPBG特定抗體水平要明顯高高于健康人 [12, 13]。
在卵巢癌和轉移癌中,TPBG可以做為一個預后評估指標。在卵巢原位癌和轉移癌的樣本中,免疫組化分析表明,TPBG高表達是卵巢癌預后不良的指標。對72例卵巢癌進行分析,71%的卵巢癌免疫組化陽性,TPBG的表達和疾病分期間關系密切,低分化卵巢癌患者,如TPBG陽性,則預后較差 [14, 15]。
在前體B細胞急性淋巴細胞白血病(ALL)的研究表明,2/3的急性B淋巴細胞系有TPBG的表達,這可能反映了前體B淋巴細胞白血病干細胞群或侵入性狀態。高表達TPBG的細胞顯著增加了CXCL12的趨化性能,猜測TPBG或可穩定趨化因子受體CXCR4在細胞膜上的表達。因此,TPBG對CXCL12/CXCR4軸產生的生物學功能有著重要影響,很可能是共同影響腫瘤發生的關鍵蛋白 [16]。
5. TPBG的臨床在研藥物
目前,多家國內外藥企正在開展以TPBG為靶點的藥物臨床試驗,包括英百瑞(杭州)生物醫藥有限公司、思道醫藥科技(蘇州)有限公司、美國Aptevo Therapeutics, Inc.、美國Inhibrx, Inc.、荷蘭Byondis BV等等。針對TPBG在研臨床藥物已高達10多款,主要用于癌癥治療,如乳腺癌、腎細胞癌、膀胱癌、非小細胞肺癌等等,涉及多種免疫療法包括單克隆抗體、雙特異性抗體、三特異性抗體、ADC、腫瘤疫苗 (表1)。如前所述,多家藥企的數據已揭示,TPBG藥物與臨床獲益密切相關,展現TPBG抗體或疫苗在癌癥治療中有重要的價值。因此,滋養層細胞糖蛋白TPBG有望成為下個抗腫瘤免疫治療的潛力靶標!
| 藥物 | 別名 | 靶點 | 作用機制 | 藥物類型 | 在研適應癥 | 在研機構 | 最高研發狀態(全球) |
|---|---|---|---|---|---|---|---|
| OXB-301 | Modified vaccinia Ankara 5T4;MVA-5T4;MVA-h 5T4;OBA 1 cancer vaccine;SAR-109659;rV-5T4-VAC;TroVax;MVA 5T4;Recombinant modified vaccinia Ankara 5T4 vaccine;5T4 cancer vaccine | 5T4 | T淋巴細胞刺激劑;5T4調節劑 | 治療性疫苗 | 腎細胞癌 | Oxford Biomedica Plc;Wales Cancer Research Centre;University of Cardiff;University College London | 臨床3期 |
| GEN-1044 | GEN 1044;DuoBody-CD3x5T4 | 5T4;CD3 | CD3調節劑;5T4調節劑 | 雙特異性抗體 | 膀胱癌;食管癌;腫瘤轉移;非小細胞肺癌;前列腺癌;三陰性乳腺癌;子宮癌;腫瘤;實體瘤 | Genmab A/S | 臨床2期 |
| Naptumomab estafenatox | TTS-CD3;Anyara;TTS CD3;ABR-217620 | 5T4 | T淋巴細胞刺激劑;5T4調節劑 | 融合蛋白;抗體偶聯毒素 | 非小細胞肺癌;實體瘤 | NeoTX Therapeutics Ltd. | 臨床2期 |
| ALG.APV-527 | ATOR-1016;ADC-1016 | 5T4;4-1BB | 4-1BB激動劑;5T4調節劑 | 雙特異性抗體 | 實體瘤;腫瘤 | Aptevo Therapeutics, Inc.;Alligator Bioscience AB | 臨床1期 |
| ASN-004 | ASN-004;Dolaflexin® ADC - Asana BioSciences;Fleximer® - ADC - Endo Pharmaceuticals/Mersana Therapeutics | 5T4 | 5T4調節劑 | ADC;單克隆抗體 | 實體瘤;乳腺癌;結直腸癌;轉移性乳腺癌;腫瘤;非小細胞肺癌;卵巢癌 | Asana BioSciences LLC | 臨床1期 |
| CBA-1535 | CBA-1535;Tb535H | 5T4;CD3 | CD3抑制劑;5T4調節劑 | 三特異性抗體 | 腫瘤 | Chiome Bioscience, Inc. | 臨床1期 |
| IBR854 | Conjugated Antibody Redirecting ready-to-use allogeneic NK cells;CAR-raNK | 5T4 | 自然殺傷細胞替代物;5T4調節劑 | CAR-NK | 實體瘤 | 英百瑞(杭州)生物醫藥有限公司 | 臨床1期 |
| SYD-1875 | Anti-5T4 antibody drug conjugate;SYD 1875 | 5T4 | 5T4調節劑 | ADC;單克隆抗體 | 實體瘤;腫瘤 | Synthon BV;Byondis BV | 臨床1期 |
| Anti-TPBG antibody-drug conjugate(XDCExplorer) | anti-TPBG antibody-drug conjugate(XDCExplorer) | 5T4 | 5T4調節劑 | ADC;單克隆抗體 | 腫瘤 | 凱惠科技發展(上海)有限公司 | 臨床前 |
| DF-7001 | DF7001 | 5T4;CD16a | 5T4調節劑;CD16a拮抗劑 | 三特異性抗體 | 炎癥;腫瘤 | Dragonfly Therapeutics, Inc.;Gilead Sciences, Inc. | 臨床前 |
| DM004 | - | 5T4;MerTK | 5T4調節劑;MerTK抑制劑 | ADC;單克隆抗體 | 實體瘤 | 思道醫藥科技(蘇州)有限公司 | 臨床前 |
| INBRX-130 | INBRX-130 | 5T4;CD3 | CD3抑制劑;5T4調節劑 | 雙特異性抗體 | 腫瘤 | Inhibrx, Inc. | 臨床前 |
| MEDI-0641 | MEDI-0641 | 5T4 | 5T4調節劑 | ADC;單克隆抗體 | 實體瘤 | MedImmune LLC | 臨床前 |
| Tb-535 | Tb535;Tb-535H | 5T4 | 5T4調節劑 | 三特異性抗體 | 實體瘤 | Biotecnol Ltd. | 臨床前 |
| 5T4-5T4-CD3 | 5T4-5T4-CD3 | 5T4;CD3 | CD3抑制劑;5T4調節劑 | 雙特異性抗體 | / | / | 無進展 (在 藥物發現) |
| 5T4-X-CD3 | 5T4-X-CD3 | 5T4;CD3 | CD3抑制劑;5T4調節劑 | 單克隆抗體 | / | / | 無進展 (在 藥物發現) |
| CME-548(Oxford Biomedica Plc) | CME-548 | 5T4 | - | ADC;單克隆抗體 | / | / | 無進展 (在 臨床前) |
| CTM-041 | CTM041;CTM 041 | 5T4;CD40 | CD40抑制劑;5T4調節劑 | 雙特異性抗體 | / | / | / |
表1:TPBG臨床研究進展
為鼎力協助各藥企針對TPBG在腫瘤臨床中的研究,CUSABIO推出TPBG活性蛋白產品(CSB-MP024093HUb0;CSB-MP024093MOV),助力您在TPBG機制方面的研究或其潛在臨床價值的探索。
● Recombinant Human Trophoblast glycoprotein(TPBG),partial (Active)
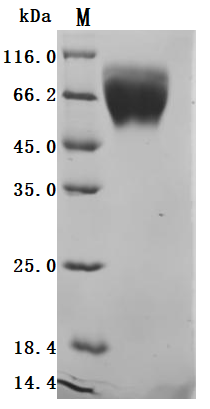
The purity was greater than 95% as determined by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
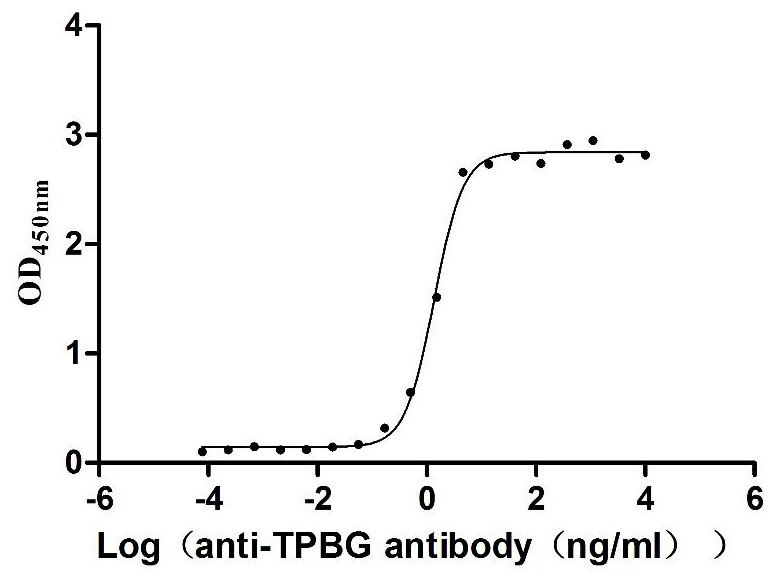
Immobilized Human TPBG at 2 μg/mL can bind Anti-TPBG recombinant antibody (CSB-RA024093MA1HU), the EC50 is 1.230-1.519 ng/mL.
● Recombinant Macaca fascicularis Trophoblast glycoprotein(TPBG),partial (Active)
The purity was greater than 95% as determined by SDS-PAGE. (Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
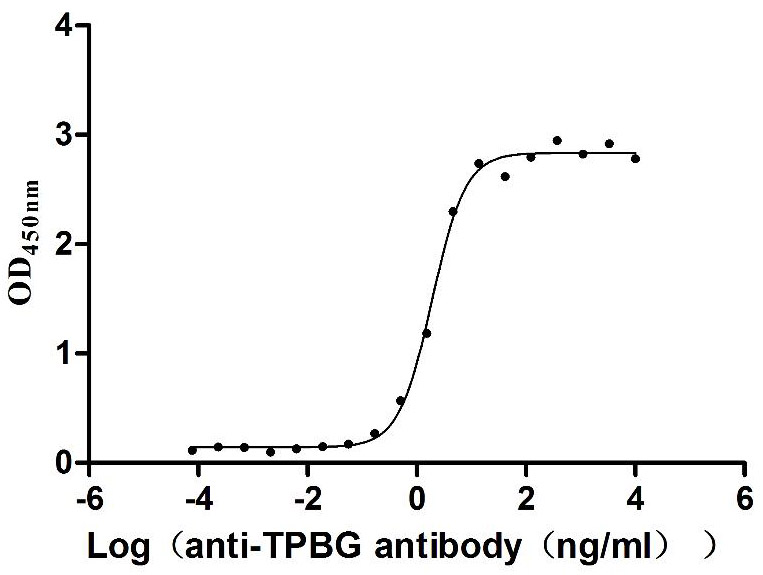
Immobilized Human TPBG at 2 μg/mL can bind Anti-TPBG recombinant antibody (CSB-RA024093MA1HU), the EC50 is 1.230-1.519 ng/mL.
參考文獻:
[1] Xu, Y., Morales, A.J., Cargill, M.J. et al. Preclinical development of T-cell receptor-engineered T-cell therapy targeting the 5T4 tumor antigen on renal cell carcinoma. Cancer Immunol Immunother 68, 1979-1993 (2019).
[2] Zhao, Yuguang, et al. "Structural insights into the inhibition of Wnt signaling by cancer antigen 5T4/Wnt-activated inhibitory factor 1." Structure 22.4 (2014): 612-620.
[3] Stern, Peter L., and Richard Harrop. "5T4 oncofoetal antigen: an attractive target for immune intervention in cancer. "Cancer Immunology, Immunotherapy 66.4 (2017): 415-426.
[4] Spencer, Helen L., et al. "Role of TPBG (trophoblast glycoprotein) antigen in human pericyte migratory and angiogenic activity. "Arteriosclerosis, Thrombosis, and Vascular Biology 39.6 (2019): 1113-1124.
[5] Harrop, Richard, Eric O'Neill, and Peter L. Stern. "Cancer stem cell mobilization and therapeutic targeting of the 5T4 oncofetal antigen. " Therapeutic advances in vaccines and immunotherapy 7 (2019): 2515135518821623.
[6] Castro, Fernanda V., et al. "5T4 oncofetal antigen is expressed in high risk of relapse childhood pre-B acute lymphoblastic leukemia and is associated with a more invasive and chemotactic phenotype." Leukemia 26.7 (2012): 1487-1498.
[7] Stern, Peter L., et al. "Understanding and exploiting 5T4 oncofoetal glycoprotein expression. "Seminars in Cancer Biology. vol. 29. Academic Press, 2014.
[8] Tsuboi, Akio. "LRR-containing oncofetal trophoblast glycoprotein 5T4 shapes neural circuits in olfactory and visual systems. "Frontiers in Molecular Neuroscience 13 (2020): 581018.
[9] Scurr, Martin, et al. "Escalating Regulation of 5T4-Specific IFN-γ+ CD4+ T Cells Distinguishes Colorectal Cancer Patients from Healthy Controls and Provides a Target for In Vivo TherapyAnti-5T4 T-cell Responses in Advanced Cancer." Cancer immunology research 1.6 (2013): 416-425.
[10] Harrop, Richard, et al. "Vaccination of colorectal cancer patients with modified vaccinia Ankara delivering the tumor antigen 5T4 (TroVax) induces immune responses which correlate with disease control: a phase I/II trial." Clinical Cancer Research 12.11 (2006): 3416-3424.
[11] Amato, Robert J., et al. "Vaccination of prostate cancer patients with modified vaccinia ankara delivering the tumor antigen 5T4 (TroVax): a phase 2 trial." Journal of immunotherapy 31.6 (2008): 577-585.
[12] Elkord, Eyad, et al. "5T4 as a target for immunotherapy in renal cell carcinoma." Expert Review of Anticancer Therapy 9.12 (2009): 1705-1709.
[13] Griffiths, Richard W., et al. "Expression of the 5T4 oncofoetal antigen in renal cell carcinoma: a potential target for T-cell-based immunotherapy." British journal of cancer 93.6 (2005): 670-677.
[14] Owens, Gemma L., et al. "Preclinical assessment of CAR T-cell therapy targeting the tumor antigen 5T4 in ovarian cancer." journal of Immunotherapy ( Hagerstown, Md.: 1997) 41.3 (2018): 130.
[15] Wan, Y. Louise, et al. "A systems biology approach to understanding the function of 5T4 oncofetal glycoprotein in ovarian cancer and the preclinical effectiveness of a 5T4 antibody drug conjugate." The Lancet 389 (2017): S100.
[16] Castro, Fernanda V., et al. "5T4 oncofetal antigen is expressed in high risk of relapse childhood pre-B acute lymphoblastic leukemia and is associated with a more invasive and chemotactic phenotype." Leukemia 26.7 (2012): 1487-1498.
[17] Starzynska, T., et al. "Prognostic significance of 5T4 oncofetal antigen expression in colorectal carcinoma." British journal of cancer 69.5 (1994): 899-902.










