【32期】前沿靶點速遞:每周醫學研究精選
日期:2025-03-19 13:19:14
01.靶點:KCTD20
應用:阿爾茨海默病和額顳葉癡呆等
來源:KCTD20 suppression mitigates excitotoxicity in tauopathy patient organoids.Neuron,2025 Feb 25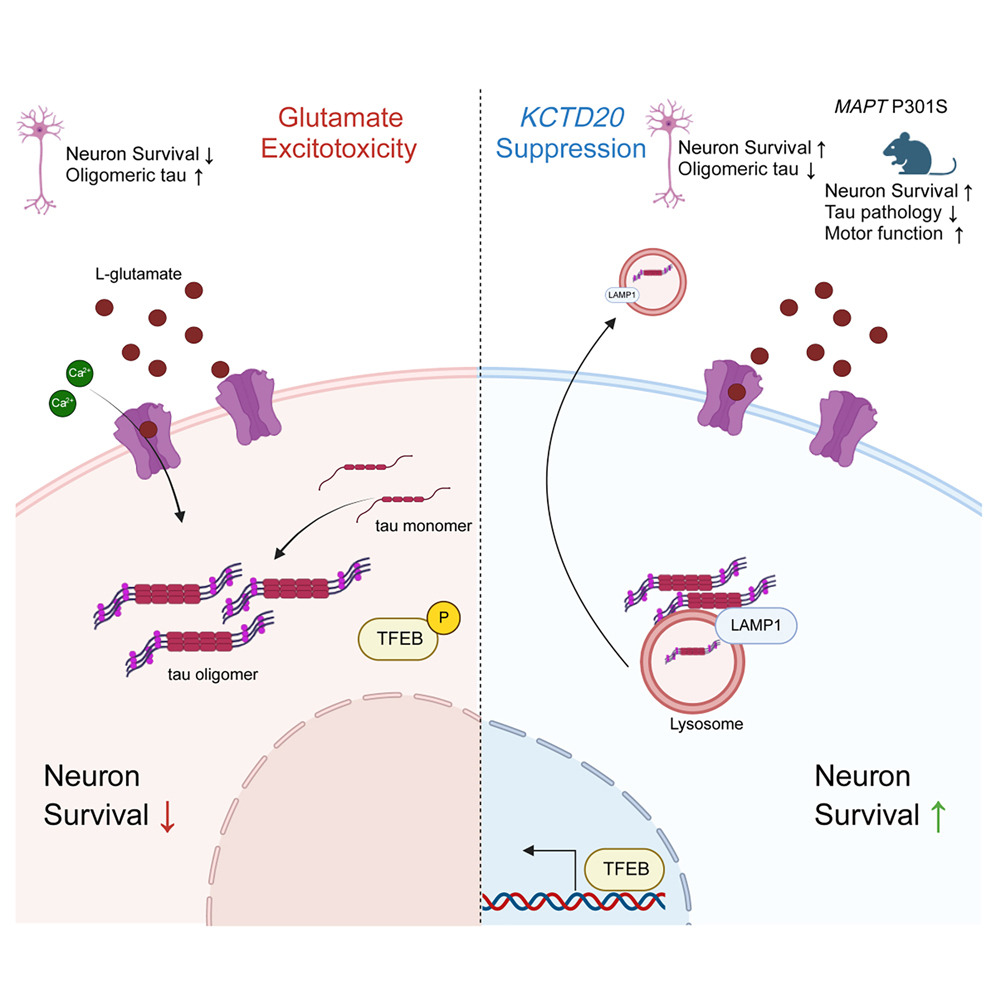
Neuron研究發現,抑制KCTD20基因能夠顯著減輕谷氨酸誘導的tau病理特征和神經元死亡。而注射KCTD20的反義寡核苷酸(ASO),能夠顯著減少小鼠大腦中的寡聚化tau蛋白并改善神經元的存活率。這項研究表明,KCTD20可以作為一種潛在的癡呆癥治療靶點,通過降低毒性蛋白的傷害來為神經元提供保護。
02.靶點:LTA4H
應用:肝細胞癌(HCC)
來源:LTA4H improves the tumor microenvironment and prevents HCC progression via targeting the HNRNPA1/LTBP1/TGF-β axis.Cell Rep Med,2025 Mar 02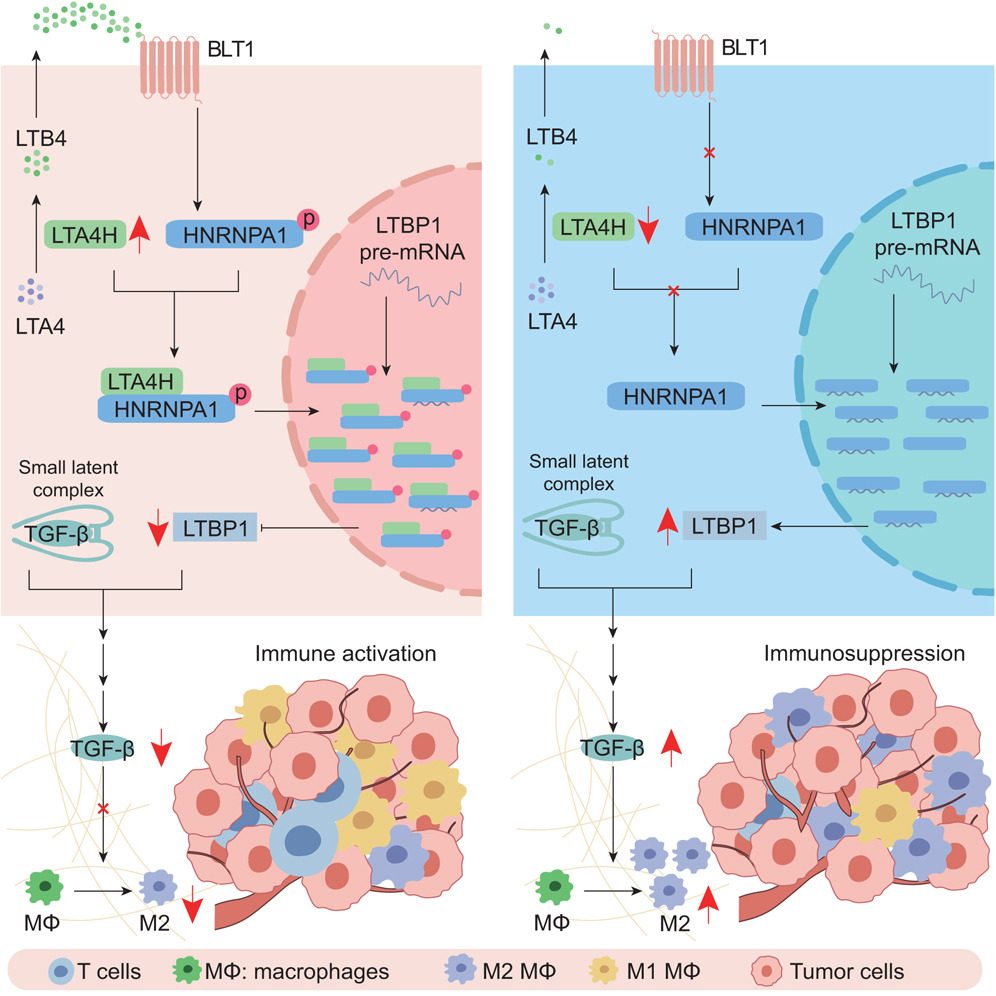
復旦大學附屬腫瘤醫院王紅陽院士團隊在《Cell Reports Medicine》發表研究,發現白三烯A4水解酶(LTA4H)是肝細胞癌(HCC)的新型防護因子。研究顯示,LTA4H通過靶向HNRNPA1/LTBP1/TGF-β信號軸,改善腫瘤微環境并抑制HCC進展。LTA4H在HCC中表達下調,其缺乏會加劇肝細胞損傷,并通過上調LTBP1和TGF-β促進CD206+巨噬細胞極化。機制上,LTA4H通過磷酸化HNRNPA1抑制LTBP1 mRNA成熟。此外,LTA4H缺陷型HCC患者預后差且對免疫治療耐藥,而TGF-β阻斷可增強其對免疫治療的敏感性。該研究為HCC的診斷和治療提供了新見解。
03.靶點:CYSLTR2、P2RY6
應用:動脈粥樣硬化及其相關心血管疾病
來源:Sensing ceramides by CYSLTR2 and P2RY6 to aggravate atherosclerosis.Nature,2025 Mar 06

04.靶點:ALKBH5
應用:2型糖尿病和代謝相關脂肪性肝病
來源:Liver ALKBH5 regulates glucose and lipid homeostasis independentlythrough GCGR and mTORC1 signaling.Science,2025 Feb 28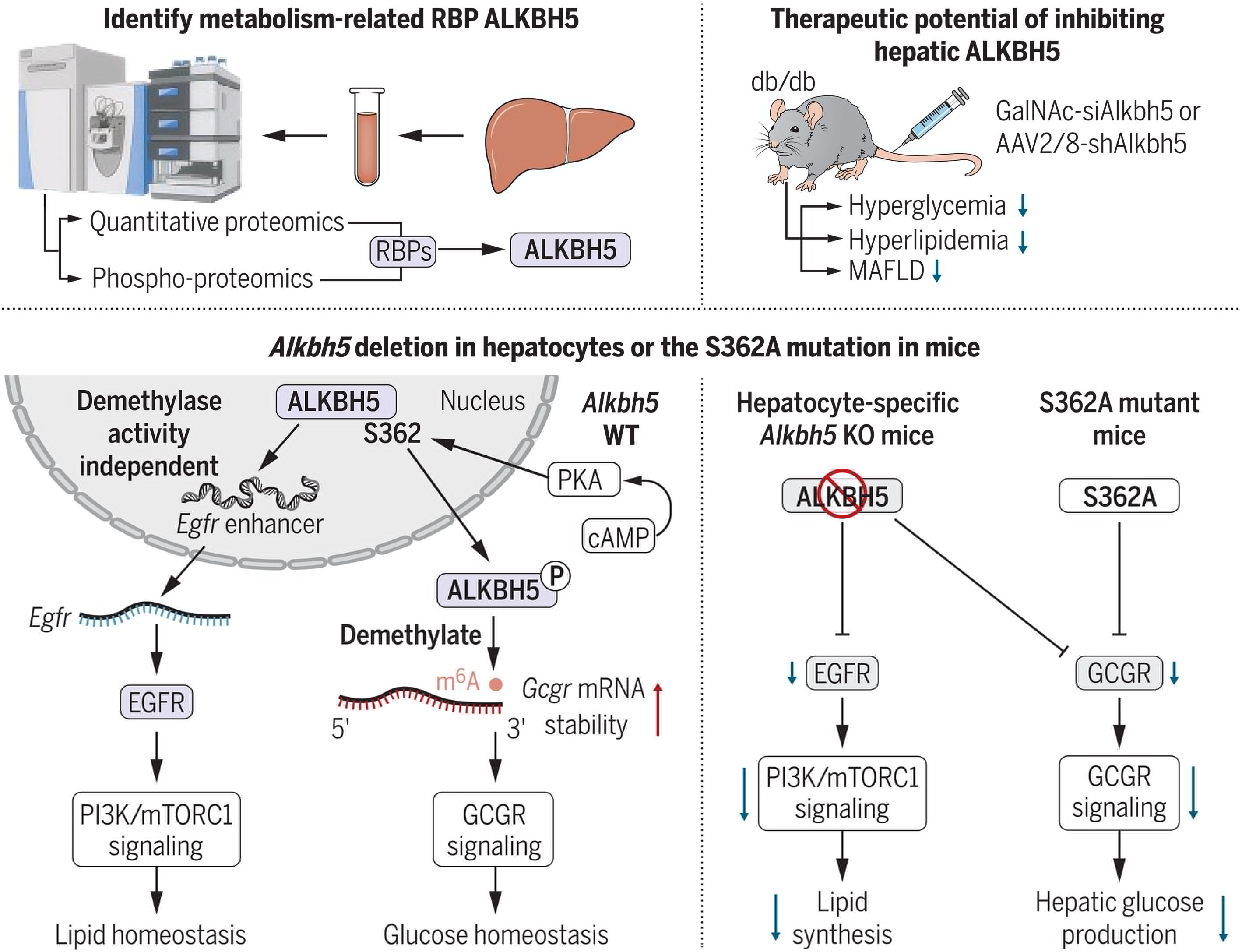
哈工大陳政課題組在《Science》發表研究,揭示ALKBH5作為糖尿病及代謝相關脂肪性肝病(MAFLD)的新靶點。研究發現,ALKBH5在肥胖糖尿病小鼠和患者肝臟中高表達,通過兩種獨立機制調控糖脂代謝穩態:一是通過磷酸化結合Gcgr mRNA,維持GCGR信號通路和糖代謝穩態;二是結合Egfr增強子DNA,促進EGFR轉錄,調控脂代謝穩態。肝細胞特異性敲除Alkbh5可改善糖耐量,減輕MAFLD。靶向敲低Alkbh5可逆轉糖尿病小鼠的高血糖和高脂血癥,顯示出治療代謝性疾病的潛力。
05.靶點:IGFBP3
應用:治療椎間盤退行性病變(IDD)的潛在靶點
來源:Efficacy of Naringenin against aging and degeneration of nucleus pulposus cells through IGFBP3 inhibition.Sci Rep,2025 Feb 25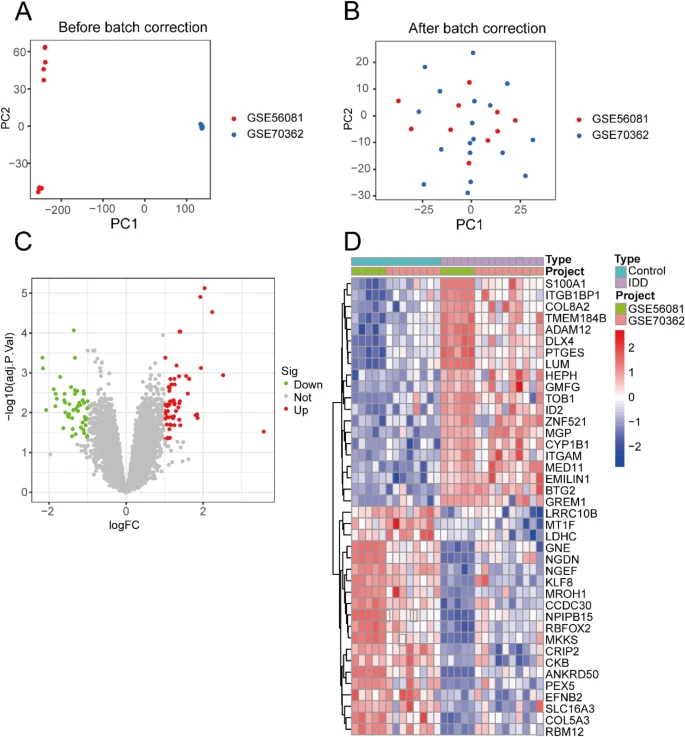
《Nature》雜志發表研究,揭示黃酮類化合物Naringenin(NAR)通過抑制IGFBP3表達,對椎間盤退行性病變(IDD)中的髓核細胞衰老和退化具有預防和治療作用。研究利用生物信息學和網絡藥理學確定NAR、衰老和IDD的共同靶點IGFBP3,并通過分子對接驗證其結合親和力。體外實驗顯示,NAR可降低IGFBP3表達,抑制由IL-1β誘導的髓核細胞衰老和退化表型,而重組IGFBP3蛋白則削弱了NAR的作用。此外,IGFBP3在IDD患者中表達增加,其沉默可顯著改善細胞衰老和退化相關指標。研究結果為IDD的治療提供了新的靶點和潛在策略。
06.靶點:PRMT5
應用:基于鐵死亡機制的癌癥治療
來源:PRMT5-mediated arginine methylation stabilizes GPX4 to suppress ferroptosis in cancer.Nat Cell Biol,2025 Mar 03
07.靶點:GOLM1
應用:治療動脈粥樣硬化的潛在靶點
來源:GOLM1 Promotes Atherogenesis by Activating Macrophage EGFR-ERK Signaling Cascade.Circ Res,2025 Mar 03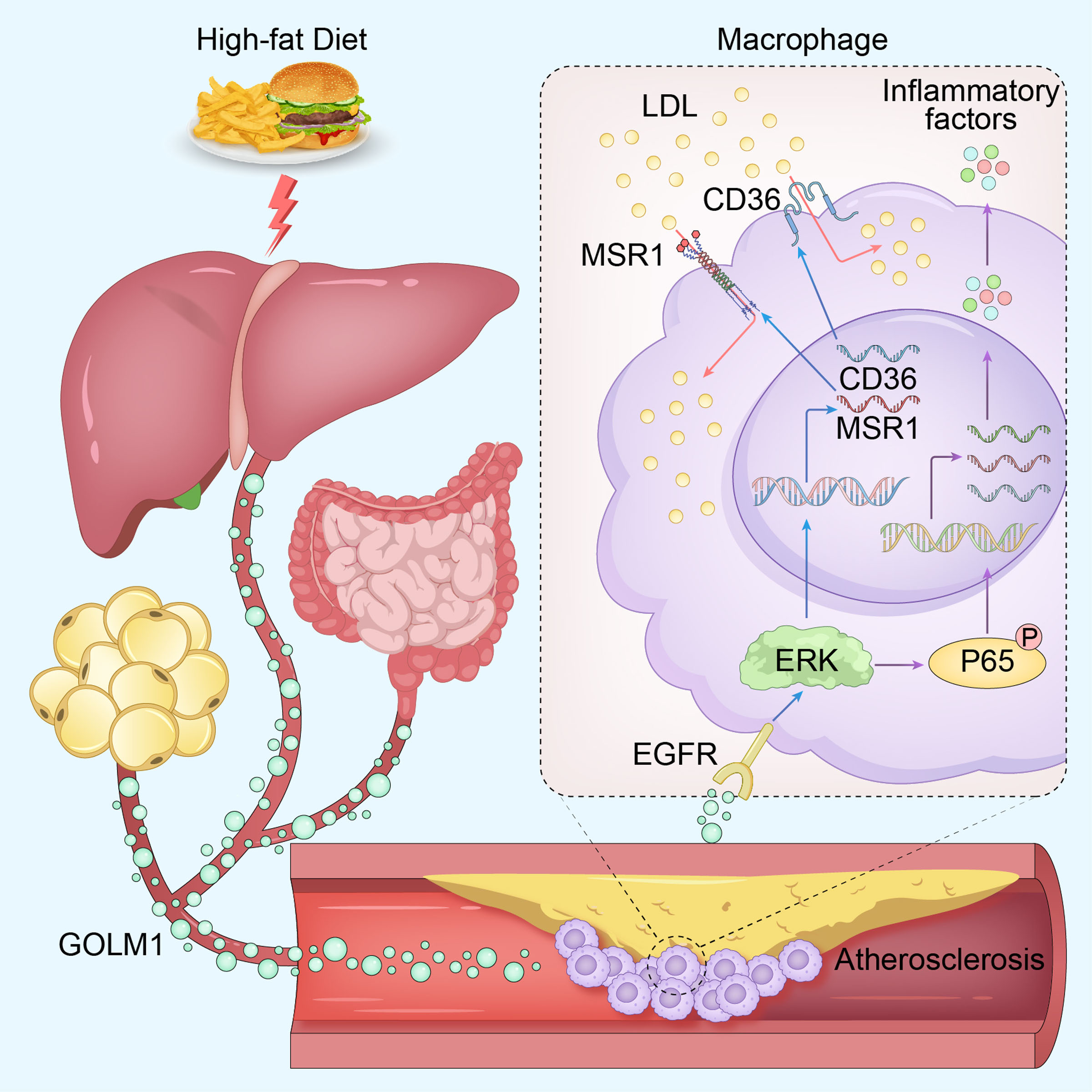
中國醫學科學院基礎醫學研究所張宏冰教授和王婧教授團隊在《Circulation Research》發表研究,揭示高爾基膜蛋白1(GOLM1)在動脈粥樣硬化中的作用機制。研究發現,GOLM1在動脈粥樣硬化患者中水平升高,且高脂飲食誘導小鼠全身多組織分泌GOLM1。GOLM1通過結合巨噬細胞上的表皮生長因子受體(EGFR),激活ERK信號通路,促進巨噬細胞吞噬低密度脂蛋白,加劇炎癥和動脈粥樣硬化。實驗中,GOLM1過表達加重小鼠動脈粥樣硬化,而GOLM1敲除或抗體中和GOLM1則顯著減輕炎癥和病變。該研究為靶向GOLM1治療動脈粥樣硬化提供了理論依據。
08.靶點:RBM42
應用:治療胰腺癌的潛在靶點
來源:Functional screen identifies RBM42 as a mediator of oncogenic mRNA translation specificity.Nat Cell Biol,2025 Mar
美國加州大學舊金山分校Davide Ruggero團隊在《Nature Cell Biology》發表研究,揭示RNA結合蛋白RBM42在胰腺癌中的作用機制。研究發現,RBM42通過直接結合MYC mRNA的5'UTR區域并改變其二級結構,促進MYC蛋白的翻譯起始,進而推動胰腺癌細胞的生長和腫瘤發展。在胰腺癌異種移植模型中,RBM42敲低顯著抑制腫瘤生長,而過表達Myc可挽救這種抑制效果,表明RBM42主要通過調控Myc蛋白表達促進腫瘤發生。該研究為靶向RBM42的胰腺癌治療提供了理論依據。
09.靶點:CGRP
應用:治療胃癌的潛在靶點
來源:Nociceptive neurons promote gastric tumour progression via a CGRP RAMP1 axis.Nature,2025 Feb 19
哥倫比亞大學歐文醫學中心和南通大學附屬醫院等機構的研究團隊在《Nature》雜志上發表研究,發現胃癌細胞與感覺神經元之間可形成突觸樣結構和功能性神經回路,通過電連接促進癌癥生長和擴散。研究指出,胃癌細胞通過釋放神經生長因子(NGF)吸引感覺神經元,并誘導其釋放降鈣素基因相關肽(CGRP),從而在腫瘤內誘發電信號。使用CGRP抑制劑治療胃癌小鼠可縮小腫瘤、延長生存期并阻止腫瘤擴散。這一發現為靶向神經系統治療胃癌提供了新思路,也為開發CGRP靶向抗癌藥物奠定了基礎。
10.靶點:SMPD3
應用:治療代謝功能障礙相關脂肪性肝炎(MASH)的潛在靶點
來源:Hepatic sphingomyelin phosphodiesterase 3 promotes steatohepatitis by disrupting membrane sphingolipid metabolism.Cell Metab,2025 Feb 20
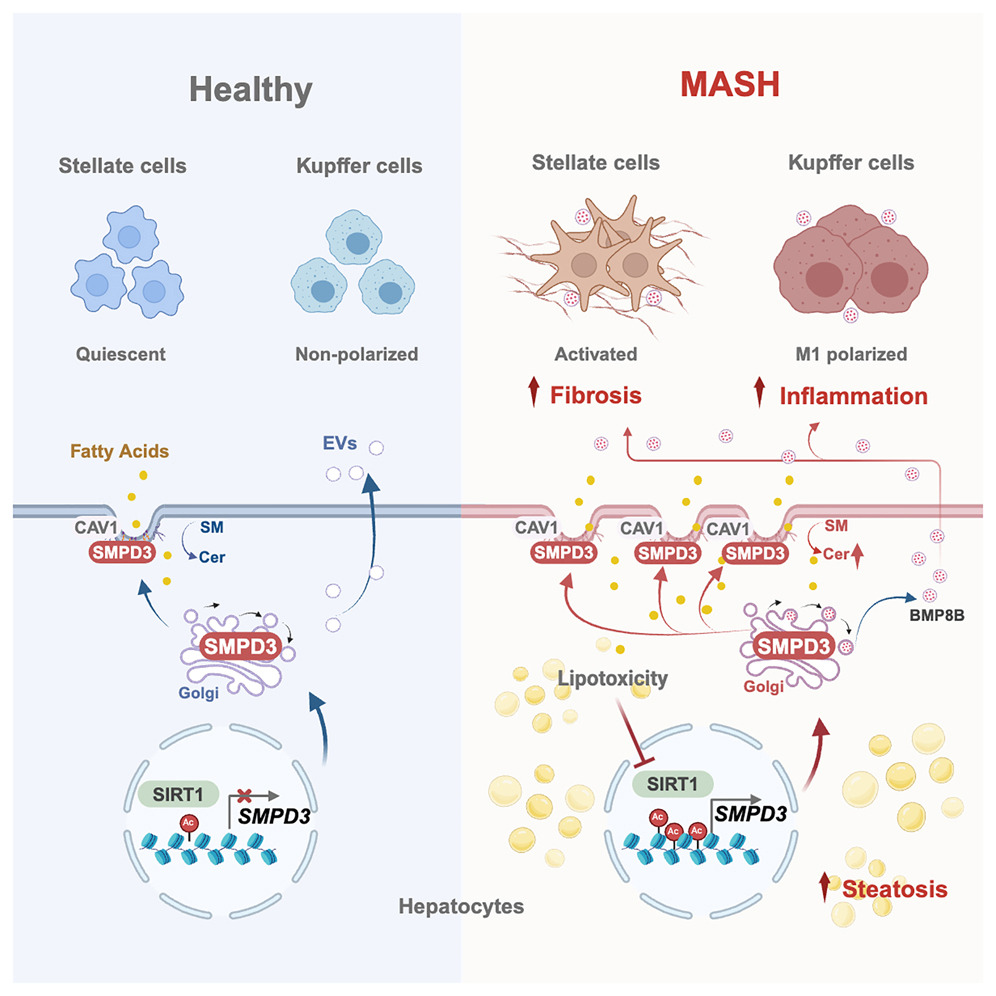
中國科學院上海藥物研究所謝岑/劉雅萌團隊、柳紅團隊與上海交通大學附屬瑞金醫院謝青團隊合作,在《Cell Metabolism》發表研究,揭示鞘磷脂磷酸二酯酶3(SMPD3)是代謝功能障礙相關脂肪性肝炎(MASH)的新靶點。研究發現,SMPD3通過破壞肝細胞膜鞘脂代謝,導致神經酰胺蓄積,加劇炎癥和纖維化。肝細胞特異性敲除或藥物抑制SMPD3可緩解MASH,而重新引入SMPD3則逆轉這種保護作用。此外,團隊發現一種雙功能化合物DC17,可同時激活SIRT1并抑制SMPD3,表現出顯著的治療效果。該研究為開發新型MASH療法提供了重要方向。
產品推薦
參考文獻
[1] KCTD20 suppression mitigates excitotoxicity in tauopathy patient organoids.Neuron,2025 Feb 25
應用:阿爾茨海默病和額顳葉癡呆等
來源:KCTD20 suppression mitigates excitotoxicity in tauopathy patient organoids.Neuron,2025 Feb 25

圖源:10.1016/j.neuron.2025.02.001[1]
Neuron研究發現,抑制KCTD20基因能夠顯著減輕谷氨酸誘導的tau病理特征和神經元死亡。而注射KCTD20的反義寡核苷酸(ASO),能夠顯著減少小鼠大腦中的寡聚化tau蛋白并改善神經元的存活率。這項研究表明,KCTD20可以作為一種潛在的癡呆癥治療靶點,通過降低毒性蛋白的傷害來為神經元提供保護。
02.靶點:LTA4H
應用:肝細胞癌(HCC)
來源:LTA4H improves the tumor microenvironment and prevents HCC progression via targeting the HNRNPA1/LTBP1/TGF-β axis.Cell Rep Med,2025 Mar 02

圖源10.1016/j.xcrm.2025.102000[2]
復旦大學附屬腫瘤醫院王紅陽院士團隊在《Cell Reports Medicine》發表研究,發現白三烯A4水解酶(LTA4H)是肝細胞癌(HCC)的新型防護因子。研究顯示,LTA4H通過靶向HNRNPA1/LTBP1/TGF-β信號軸,改善腫瘤微環境并抑制HCC進展。LTA4H在HCC中表達下調,其缺乏會加劇肝細胞損傷,并通過上調LTBP1和TGF-β促進CD206+巨噬細胞極化。機制上,LTA4H通過磷酸化HNRNPA1抑制LTBP1 mRNA成熟。此外,LTA4H缺陷型HCC患者預后差且對免疫治療耐藥,而TGF-β阻斷可增強其對免疫治療的敏感性。該研究為HCC的診斷和治療提供了新見解。
03.靶點:CYSLTR2、P2RY6
應用:動脈粥樣硬化及其相關心血管疾病
來源:Sensing ceramides by CYSLTR2 and P2RY6 to aggravate atherosclerosis.Nature,2025 Mar 06

圖源:10.1038/s41586-025-08792-8[3]
北京大學孔煒教授團隊聯合多個研究團隊在《Nature》發表論文,發現動脈粥樣硬化的新治療靶點。研究首次鑒定神經酰胺的內源性受體CYSLTR2和P2RY6,揭示神經酰胺通過激活這些受體加重動脈粥樣硬化的分子機制。團隊通過系統篩選發現,CYSLTR2和P2RY6是神經酰胺C16:0在內皮細胞和巨噬細胞中的關鍵受體,其激活可誘導炎癥小體活化。抑制這些受體可減輕神經酰胺誘導的動脈粥樣硬化加重,且不影響膽固醇或神經酰胺水平。該研究還解析了神經酰胺-CYSLTR2復合物結構,為開發針對動脈粥樣硬化的新型治療策略提供了理論基礎。04.靶點:ALKBH5
應用:2型糖尿病和代謝相關脂肪性肝病
來源:Liver ALKBH5 regulates glucose and lipid homeostasis independentlythrough GCGR and mTORC1 signaling.Science,2025 Feb 28

圖源:10.1126/science.adp4120[4]
哈工大陳政課題組在《Science》發表研究,揭示ALKBH5作為糖尿病及代謝相關脂肪性肝病(MAFLD)的新靶點。研究發現,ALKBH5在肥胖糖尿病小鼠和患者肝臟中高表達,通過兩種獨立機制調控糖脂代謝穩態:一是通過磷酸化結合Gcgr mRNA,維持GCGR信號通路和糖代謝穩態;二是結合Egfr增強子DNA,促進EGFR轉錄,調控脂代謝穩態。肝細胞特異性敲除Alkbh5可改善糖耐量,減輕MAFLD。靶向敲低Alkbh5可逆轉糖尿病小鼠的高血糖和高脂血癥,顯示出治療代謝性疾病的潛力。
05.靶點:IGFBP3
應用:治療椎間盤退行性病變(IDD)的潛在靶點
來源:Efficacy of Naringenin against aging and degeneration of nucleus pulposus cells through IGFBP3 inhibition.Sci Rep,2025 Feb 25

圖源:10.1038/s41598-025-90909-0[5]
《Nature》雜志發表研究,揭示黃酮類化合物Naringenin(NAR)通過抑制IGFBP3表達,對椎間盤退行性病變(IDD)中的髓核細胞衰老和退化具有預防和治療作用。研究利用生物信息學和網絡藥理學確定NAR、衰老和IDD的共同靶點IGFBP3,并通過分子對接驗證其結合親和力。體外實驗顯示,NAR可降低IGFBP3表達,抑制由IL-1β誘導的髓核細胞衰老和退化表型,而重組IGFBP3蛋白則削弱了NAR的作用。此外,IGFBP3在IDD患者中表達增加,其沉默可顯著改善細胞衰老和退化相關指標。研究結果為IDD的治療提供了新的靶點和潛在策略。
06.靶點:PRMT5
應用:基于鐵死亡機制的癌癥治療
來源:PRMT5-mediated arginine methylation stabilizes GPX4 to suppress ferroptosis in cancer.Nat Cell Biol,2025 Mar 03

圖源:10.1038/s41556-025-01610-3[6]
西安交通大學第一附屬醫院李磊教授聯合德克薩斯大學MD安德森癌癥中心甘波誼教授和哈佛大學醫學院魏文毅教授團隊在《Nature Cell Biology》發表研究,揭示PRMT5是癌癥鐵死亡療法的新靶點。研究發現,PRMT5介導的甲基化可增強谷胱甘肽過氧化物酶4(GPX4)的穩定性,從而抑制鐵死亡。PRMT5通過催化GPX4在第152位精氨酸殘基的甲基化,阻止其泛素化降解,延長其半衰期。抑制PRMT5可降低GPX4水平,增強鐵死亡誘導劑的敏感性。在小鼠腫瘤模型中,PRMT5抑制劑與鐵死亡治療聯合使用顯著抑制腫瘤進展。該研究為癌癥治療提供了新策略。07.靶點:GOLM1
應用:治療動脈粥樣硬化的潛在靶點
來源:GOLM1 Promotes Atherogenesis by Activating Macrophage EGFR-ERK Signaling Cascade.Circ Res,2025 Mar 03

圖源:10.1161/CIRCRESAHA.124.325880[7]
中國醫學科學院基礎醫學研究所張宏冰教授和王婧教授團隊在《Circulation Research》發表研究,揭示高爾基膜蛋白1(GOLM1)在動脈粥樣硬化中的作用機制。研究發現,GOLM1在動脈粥樣硬化患者中水平升高,且高脂飲食誘導小鼠全身多組織分泌GOLM1。GOLM1通過結合巨噬細胞上的表皮生長因子受體(EGFR),激活ERK信號通路,促進巨噬細胞吞噬低密度脂蛋白,加劇炎癥和動脈粥樣硬化。實驗中,GOLM1過表達加重小鼠動脈粥樣硬化,而GOLM1敲除或抗體中和GOLM1則顯著減輕炎癥和病變。該研究為靶向GOLM1治療動脈粥樣硬化提供了理論依據。
08.靶點:RBM42
應用:治療胰腺癌的潛在靶點
來源:Functional screen identifies RBM42 as a mediator of oncogenic mRNA translation specificity.Nat Cell Biol,2025 Mar

圖源:10.1038/s41556-024-01604-7[8]
美國加州大學舊金山分校Davide Ruggero團隊在《Nature Cell Biology》發表研究,揭示RNA結合蛋白RBM42在胰腺癌中的作用機制。研究發現,RBM42通過直接結合MYC mRNA的5'UTR區域并改變其二級結構,促進MYC蛋白的翻譯起始,進而推動胰腺癌細胞的生長和腫瘤發展。在胰腺癌異種移植模型中,RBM42敲低顯著抑制腫瘤生長,而過表達Myc可挽救這種抑制效果,表明RBM42主要通過調控Myc蛋白表達促進腫瘤發生。該研究為靶向RBM42的胰腺癌治療提供了理論依據。
09.靶點:CGRP
應用:治療胃癌的潛在靶點
來源:Nociceptive neurons promote gastric tumour progression via a CGRP RAMP1 axis.Nature,2025 Feb 19

圖源:10.1038/s41586-025-08591-1[9]
哥倫比亞大學歐文醫學中心和南通大學附屬醫院等機構的研究團隊在《Nature》雜志上發表研究,發現胃癌細胞與感覺神經元之間可形成突觸樣結構和功能性神經回路,通過電連接促進癌癥生長和擴散。研究指出,胃癌細胞通過釋放神經生長因子(NGF)吸引感覺神經元,并誘導其釋放降鈣素基因相關肽(CGRP),從而在腫瘤內誘發電信號。使用CGRP抑制劑治療胃癌小鼠可縮小腫瘤、延長生存期并阻止腫瘤擴散。這一發現為靶向神經系統治療胃癌提供了新思路,也為開發CGRP靶向抗癌藥物奠定了基礎。
10.靶點:SMPD3
應用:治療代謝功能障礙相關脂肪性肝炎(MASH)的潛在靶點
來源:Hepatic sphingomyelin phosphodiesterase 3 promotes steatohepatitis by disrupting membrane sphingolipid metabolism.Cell Metab,2025 Feb 20

圖源:10.1016/j.cmet.2025.01.016[10]
中國科學院上海藥物研究所謝岑/劉雅萌團隊、柳紅團隊與上海交通大學附屬瑞金醫院謝青團隊合作,在《Cell Metabolism》發表研究,揭示鞘磷脂磷酸二酯酶3(SMPD3)是代謝功能障礙相關脂肪性肝炎(MASH)的新靶點。研究發現,SMPD3通過破壞肝細胞膜鞘脂代謝,導致神經酰胺蓄積,加劇炎癥和纖維化。肝細胞特異性敲除或藥物抑制SMPD3可緩解MASH,而重新引入SMPD3則逆轉這種保護作用。此外,團隊發現一種雙功能化合物DC17,可同時激活SIRT1并抑制SMPD3,表現出顯著的治療效果。該研究為開發新型MASH療法提供了重要方向。
產品推薦
| 靶點 | 重組蛋白 | 貨號 |
| ALKBH5 | Recombinant Human Probable alpha-ketoglutarate-dependent dioxygenase ABH5 (ALKBH5) | CSB-EP744062HU |
| CGRP/CALCA | Recombinant Human Calcitonin gene-related peptide 1 (CALCA), partial | CSB-MP153444HU |
| CYSLTR2 | Recombinant Mouse Calcitonin gene-related peptide 1 (Calca), partial | CSB-MP859124MO |
| GOLM1 | Recombinant Dog Calcitonin (CALCA), partial | CSB-EP004434DO |
| IGFBP3 | Recombinant Human Cysteinyl leukotriene receptor 2 (CYSLTR2), partial | CSB-MP006466HU1 |
| KCTD20 | Recombinant Human Golgi membrane protein 1 (GOLM1), partial | CSB-EP009666HU |
| LTA4H | Recombinant Mouse Golgi membrane protein 1 (Golm1), partial | CSB-EP009666MO |
| P2RY6 | Recombinant Human Insulin-like growth factor-binding protein 3 protein (IGFBP3) | CSB-AP002491HU |
| PRMT5 | Recombinant Human BTB/POZ domain-containing protein KCTD20 (KCTD20) | CSB-MP773599HU |
| RBM42 | Recombinant Human Leukotriene A-4 hydrolase (LTA4H) | CSB-MP013219HU |
| SMPD3 | Recombinant Human P2Y purinoceptor 6 (P2RY6), partial | CSB-MP618975HU1 |
參考文獻
[1] KCTD20 suppression mitigates excitotoxicity in tauopathy patient organoids.Neuron,2025 Feb 25
[2]LTA4H improves the tumor microenvironment and prevents HCC progression via targeting the HNRNPA1/LTBP1/TGF-β axis.Cell Rep Med,2025 Mar 02
[3]Sensing ceramides by CYSLTR2 and P2RY6 to aggravate atherosclerosis.Nature,2025 Mar 06
[4]Liver ALKBH5 regulates glucose and lipid homeostasis independentlythrough GCGR and mTORC1 signaling.Science,2025 Feb 28
[5]Efficacy of Naringenin against aging and degeneration of nucleus pulposus cells through IGFBP3 inhibition.Sci Rep,2025 Feb 25
[6]PRMT5-mediated arginine methylation stabilizes GPX4 to suppress ferroptosis in cancer.Nat Cell Biol,2025 Mar 03
[7]GOLM1 Promotes Atherogenesis by Activating Macrophage EGFR-ERK Signaling Cascade.Circ Res,2025 Mar 03
[8]Functional screen identifies RBM42 as a mediator of oncogenic mRNA translation specificity.Nat Cell Biol,2025 Mar
[9]Nociceptive neurons promote gastric tumour progression via a CGRP RAMP1 axis.Nature,2025 Feb 19
[10]Hepatic sphingomyelin phosphodiesterase 3 promotes steatohepatitis by disrupting membrane sphingolipid metabolism.Cell Metab,2025 Feb 20
*免責聲明:華美生物內容團隊僅是分享和解讀公開研究論文及其發現,本文僅作信息交流,文中觀點不代表華美生物立場,請理解。
上一篇: 【31期】前沿靶點速遞:每周醫學研究精選
下一篇: 【33期】前沿靶點速遞:每周醫學研究精選










