蛋白質(zhì)乙酰化: 真核細(xì)胞中的一種重要翻譯后修飾
日期:2024-02-02 16:03:52
眾所周知,翻譯后修飾(PTM)是真核細(xì)胞實(shí)現(xiàn)蛋白質(zhì)功能多樣化和動(dòng)態(tài)協(xié)調(diào)信號(hào)網(wǎng)絡(luò)的重要機(jī)制。1964年,Vincent Allfrey及其同事首次發(fā)現(xiàn)了組蛋白上的賴(lài)氨酸乙酰化修飾。隨后,以質(zhì)譜儀為基礎(chǔ)的蛋白質(zhì)組學(xué)大大加速了內(nèi)源性乙酰化蛋白質(zhì)的發(fā)現(xiàn)和鑒定,同時(shí)也揭示了非組蛋白乙酰化的調(diào)控過(guò)程。乙酰化修飾是一種進(jìn)化保守的PTM,存在于原核生物和真核生物中。下文將重點(diǎn)介紹蛋白質(zhì)乙酰化的定義、功能、機(jī)制以及相關(guān)疾病。
1. 什么是蛋白質(zhì)乙酰化?
蛋白質(zhì)乙酰化是真核生物中主要的翻譯后修飾(PTMs)之一,其中乙酰輔酶A(Ac-CoA)的乙酰基被引入多肽鏈上的特定位點(diǎn) [1]。蛋白質(zhì)被乙酰化的部位要么是各種氨基末端殘基,要么是賴(lài)氨酸殘基的ε-氨基。大多數(shù)真核生物蛋白質(zhì)和調(diào)節(jié)肽在氨基末端殘基上發(fā)生乙酰化,而賴(lài)氨酸乙酰化則發(fā)生在組蛋白和轉(zhuǎn)錄因子等不同蛋白質(zhì)的不同位點(diǎn)上。
2. 蛋白質(zhì)乙酰化的功能
人類(lèi)的大多數(shù)蛋白質(zhì)都會(huì)發(fā)生乙酰化。蛋白質(zhì)的乙酰化可影響蛋白質(zhì)的電荷、構(gòu)象、穩(wěn)定性、定位、合成以及與其他分子的相互作用。已發(fā)現(xiàn)許多乙酰化蛋白質(zhì)參與了多種細(xì)胞過(guò)程,如翻譯、轉(zhuǎn)錄、蛋白質(zhì)折疊、細(xì)胞分裂、DNA損傷修復(fù)、信號(hào)轉(zhuǎn)導(dǎo)和新陳代謝。組蛋白的乙酰化可降低其正電荷,削弱其與DNA結(jié)合的能力,并導(dǎo)致核小體解聚,從而使轉(zhuǎn)錄因子和RNA聚合酶順利與DNA結(jié)合,激活基因的轉(zhuǎn)錄活性。研究發(fā)現(xiàn),乙酰化可影響核酸酶的酶活性,從而調(diào)節(jié)底物RNA的水平 [7]。乙酰化還能調(diào)節(jié)100多種非組蛋白,包括轉(zhuǎn)錄因子、轉(zhuǎn)錄輔激活因子和核受體 [8]。非組蛋白乙酰化使細(xì)胞功能復(fù)雜化,而線粒體關(guān)鍵酶的乙酰化則調(diào)節(jié)生物能代謝。蛋白質(zhì)乙酰化還與蛋白質(zhì)降解有關(guān)。此外,蛋白質(zhì)乙酰化還能調(diào)節(jié)多種信號(hào)通路并影響細(xì)胞周期。
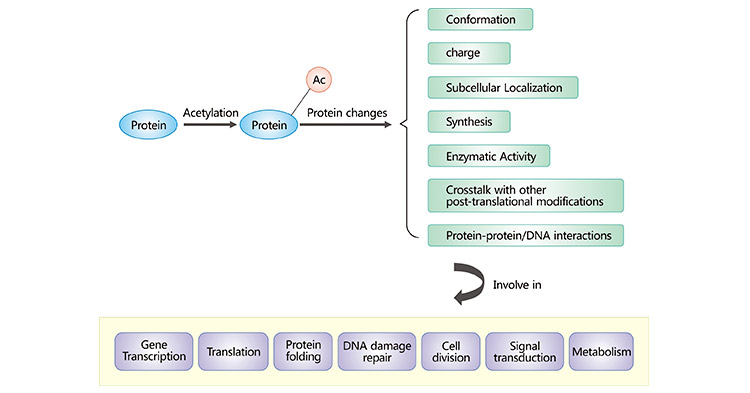
圖1. 蛋白質(zhì)乙酰化在真核細(xì)胞中的作用
3. 蛋白質(zhì)乙酰化的機(jī)制
研究最多的蛋白質(zhì)乙酰化發(fā)生在氨基上,但也檢測(cè)到絲氨酸、蘇氨酸和組氨酸殘基上的乙酰化。蛋白質(zhì)氨基的乙酰化有三種不同的機(jī)制:賴(lài)氨酸乙酰化(N?-乙酰化)、蛋白質(zhì)N端乙酰化(N α-乙酰化)和O-乙酰化。
3.1 N?-賴(lài)氨酸乙酰化
賴(lài)氨酸乙酰化又稱(chēng) N?-賴(lài)氨酸乙酰化,是指將乙酰基從乙酰輔酶 A(乙酰輔酶 A)轉(zhuǎn)移到蛋白質(zhì)中賴(lài)氨酸側(cè)鏈 ? 位的伯胺上。這一可逆過(guò)程中和了賴(lài)氨酸側(cè)鏈?位的正電荷。失去正電荷和增大的賴(lài)氨酸會(huì)破壞鹽橋并引入立體結(jié)構(gòu),從而改變蛋白質(zhì)-蛋白質(zhì)/DNA 之間的相互作用、穩(wěn)定性和酶活性 [2][3]。
有力的證據(jù)表明,蛋白質(zhì)賴(lài)氨酸乙酰化可通過(guò)兩種不同的機(jī)制發(fā)生:酶促乙酰化和非酶促乙酰化(化學(xué)乙酰化)[4]。兩種不同的機(jī)制顯示了對(duì)不同賴(lài)氨酸乙酰化位點(diǎn)的偏好,并揭示了這些賴(lài)氨酸位點(diǎn)相對(duì)乙酰化變化的不同動(dòng)態(tài)。
酶促乙酰化依靠乙酰輔酶 A(Ac-CoA)乙酰轉(zhuǎn)移酶催化乙酰基向賴(lài)氨酸殘基的?-氨基轉(zhuǎn)移。非酶促乙酰化發(fā)生在乙酰供體和蛋白質(zhì)之間。在真核細(xì)胞中,特別是在線粒體內(nèi),高能硫代酯類(lèi) AcCoA 可對(duì)蛋白質(zhì)進(jìn)行化學(xué)乙酰化 [16]。
3.2 Nα-乙酰化
Nα-乙酰化是指在N端氨基酸的 α-氨基上添加乙酰基。這是一個(gè)典型的不可逆過(guò)程,由 N-α-乙酰轉(zhuǎn)移酶(NATs)介導(dǎo)。大約85%的人類(lèi)蛋白質(zhì)是通過(guò) Nα-乙酰化修飾的 [5]。在真核生物中,Nα-乙酰化非常常見(jiàn),而且是翻譯過(guò)程中的共同作用,但在細(xì)菌中卻很少見(jiàn),而且是翻譯后的作用 [17]。在真核細(xì)胞中,Nα-乙酰化要么發(fā)生在蛋氨酸的游離氨基上,要么發(fā)生在N端蛋氨酸裂解后暴露的氨基酸上。在細(xì)菌、線粒體和葉綠體中,Nα-乙酰化是翻譯后進(jìn)行的,因?yàn)榈鞍彼岜仨毷紫冗M(jìn)行變形。
3.3 O-乙酰化
O-乙酰化是指在酪氨酸/絲氨酸/蘇氨酸殘基的羥基上添加乙酰基 [6]。它已被確定為蛋白質(zhì)乙酰化的第三種類(lèi)型。耶爾森氏菌外層蛋白J(YopJ)會(huì)對(duì)激活MAPK/ERK激酶和IκB激酶家族所需的絲氨酸和蘇氨酸殘基側(cè)鏈進(jìn)行乙酰化,從而阻斷它們的磷酸化,抑制信號(hào)轉(zhuǎn)導(dǎo)。蛋白質(zhì)N-聚糖中的硅醛酸的O-乙酰化是一種重要的修飾,可以在 4-、7-、8-或9-位上以不同的組合出現(xiàn)。
4. 蛋白質(zhì)乙酰化與疾病
功能蛋白的乙酰化和去乙酰化在胚胎發(fā)育、出生后成熟、心肌細(xì)胞分化、心臟重塑以及各種心血管疾病(包括肥胖、糖尿病、心臟代謝性疾病、缺血再灌注損傷以及心臟重塑、高血壓和心律失常等)的發(fā)病過(guò)程中發(fā)揮著重要作用 [10] [11]。
歐陽(yáng)潔等研究表明,腎小管上皮細(xì)胞線粒體中 SOD2 和 p53 蛋白乙酰化的升高是缺血再灌注(I/R)誘導(dǎo)急性腎損傷(AKI)發(fā)病機(jī)制中的一個(gè)重要信號(hào)事件 [9]。一些研究還表明,恢復(fù) SIRT1/3 的活性可能是治療 AKI 的新靶點(diǎn)。SIRT1 和 3 是依賴(lài)于煙酰胺腺嘌呤二核苷酸的蛋白去乙酰化酶,在抗氧化應(yīng)激和抗細(xì)胞凋亡過(guò)程中發(fā)揮保護(hù)腎功能的作用。使用白藜蘆醇可以有效恢復(fù)SIRT1/3的活性。研究表明,TDP-43的K136乙酰化會(huì)損害其RNA結(jié)合和剪接能力,促進(jìn)病理磷酸化和泛素化TDP-43的不溶性聚集體的積累,這與肌萎縮性脊髓側(cè)索硬化癥(ALS)有關(guān)。
某些蛋白質(zhì)的乙酰化與癌變有關(guān)。與相應(yīng)的非腫瘤組織細(xì)胞相比,結(jié)腸癌相關(guān)轉(zhuǎn)錄因子1(CCAT1)在食管鱗狀細(xì)胞癌(ESCC)細(xì)胞中的表達(dá)明顯更高 [12]。眾所周知,CCAT1的高表達(dá)可促進(jìn)細(xì)胞增殖和侵襲,而下調(diào) CCAT1 則可抑制這兩個(gè)生物學(xué)過(guò)程 [13]。據(jù)報(bào)道,H3K27的乙酰化可部分上調(diào)CCAT1的表達(dá),而CCAT1有可能誘發(fā)癌癥 [14]。此外,糖酵解為癌細(xì)胞快速增殖提供了大量能量。磷酸甘油酸激酶1(PGK1)是糖酵解過(guò)程中的重要還原酶,如果發(fā)生乙酰化,可能會(huì)改變癌細(xì)胞的增殖。在肝癌細(xì)胞中,PGK1的活性會(huì)因乙酰化而增強(qiáng),并進(jìn)一步加速腫瘤細(xì)胞的增殖 [15]。
質(zhì)譜技術(shù)與生物學(xué)的結(jié)合使大量乙酰化位點(diǎn)在所有蛋白質(zhì)中的定位成為可能。越來(lái)越多的研究表明,乙酰化是自然界中最豐富的化學(xué)修飾之一,可能影響蛋白質(zhì)的各種生理過(guò)程,甚至導(dǎo)致某些疾病。因此,蛋白質(zhì)乙酰化也是近年來(lái)開(kāi)發(fā)和設(shè)計(jì)治療多種疾病的新藥的一個(gè)很有前景的靶點(diǎn)。
5. 乙酰化相關(guān)產(chǎn)物
許多乙酰轉(zhuǎn)移酶都參與了蛋白質(zhì)的乙酰化過(guò)程。在此,CUSABIO為科研人員提供一些優(yōu)質(zhì)的乙酰轉(zhuǎn)移酶,用于蛋白質(zhì)乙酰化相關(guān)的研究。
| 乙酰化蛋白 | 乙酰轉(zhuǎn)移酶 |
|---|---|
| Human proteins | NatA (catalytic subunit: Naa10, Naa15 ), NatB (Naa20, Naa25), NatC (Naa30, Naa35, Naa38), NatD (Naa40), NatE (Naa50), NatF (Naa60), NatH (Naa80) |
| Histones (H2A, H2B, H3, H4) | Gcn5, PCAF, Hat1, Elp3, Hpa2, Esa1, MOF, Sas2, Sas3, Tip60, MORF, TAFII250, TFIIIC, ACTR, and SRC1. |
| E. coli ribosomal proteins (S18, S5, and L12) | RimI, RimJ, RimL |
| Transcription factors (p53, E2F1-3, EKLF) | PCAF/Gcn5, p300/CBP, TAFII250 |
| Nuclear import factors (importin-α7 and Rch1) | p300/CBP |
參考文獻(xiàn):
[1] Adrian Drazica, Line M.Myklebust, et al. The world of protein acetylation [J]. Biochimica et Biophysica Acta (BBA) - Proteins and Proteomics Volume 1864, Issue 10, October 2016, Pages 1372-1401.
[2] David G. Christensen, Xueshu Xie, et al. Post-translational Protein Acetylation: An Elegant Mechanism for Bacteria to Dynamically Regulate Metabolic Functions [J]. Front Microbiol. 2019; 10: 1604.
[3] Ibraheem Ali, Ryan J. Conrad, et al. Lysine Acetylation Goes Global: From Epigenetics to Metabolism and Therapeutics [J]. Chem Rev. Author manuscript; available in PMC 2019 Jul 3.
[4] Miao-Miao Wang, Di You & Bang-Ce Ye. Site-specific and kinetic characterization of enzymatic and nonenzymatic protein acetylation in bacteria [J]. Sci Rep 7, 14790 (2017).
[5] Hollebeke J, Van Damme P and Gevaert K: N-terminal acetylation and other functions of Nalpha-acetyltransferases [J]. Biol Chem. 393:291–298. 2012.
[6] Yang XJ and Gregoire S. Metabolism, cytoskeleton and cellular signalling in the grip of protein Nepsilon- and O-acetylation [J]. EMBO Rep. 8:556–562. 2007.
[7] Song L, Wang G, et al. Reversible acetylation on Lys501 regulates the activity of RNase II [J]. Nucleic Acids Res. 2016;44:1979–1988.
[8] Narita T, Weinert BT, et al. Functions and mechanisms of non-histone protein acetylation [J]. Nat Rev Mol Cell Biol. 2019;20:156–174.
[9] Jie Ouyang, Zhenhua Zeng, et al. SIRT3 Inactivation Promotes Acute Kidney Injury Through Elevated Acetylation of SOD2 and p53 [J]. J Surg Res. 2019 Jan;233:221-230.
[10] Can Xia, Yu Tao, et al. Protein acetylation and deacetylation: An important regulatory modification in gene transcription (Review) [J]. Exp Ther Med. 2020 Oct; 20(4): 2923–2940.
[11] MingjieYang, YingmeiZhang, et al. Acetylation in cardiovascular diseases: Molecular mechanisms and clinical implications [J]. Biochimica et Biophysica Acta (BBA) - Molecular Basis of Disease Volume 1866, Issue 10, 1 October 2020, 165836.
[12] Hu M, Zhang Q, et al. lncRNA CCAT1 is a biomarker for the proliferation and drug resistance of esophageal cancer via the miR- 143/PLK1/BUBR1 axis [J]. Mol Carcinog. 2019;58:2207–2217.
[13] Li J and Qi Y. Ginsenoside Rg3 inhibits cell growth, migration and invasion in Caco-2 cells by downregulation of lncRNA CCAT1 [J]. Exp Mol Pathol. 2019;106:131–138.
[14] Zhang E, Han L, et al. H3K27 acetylation activated-long non-coding RNA CCAT1 affects cell proliferation and migration by regulating SPRY4 and HOXB13 expression in esophageal squamous cell carcinoma [J]. Nucleic Acids Res. 2017;45:3086–3101.
[15] Hu H, Zhu W, et al. Acetylation of PGK1 promotes liver cancer cell proliferation and tumorigenesis [J]. Hepatology. 2017;65:515–528.
[16] Hosp F, Lassowskat I, et al. Lysine acetylation in mitochondria: from inventory to function [J]. Mitochondrion 2017. 33:58–71.
[17] Soppa J. Protein acetylation in archaea, bacteria, and eukaryotes [J]. Archaea 2010:820681.










