CCR8:Tregs細胞的特異性靶點,催生下一代重磅腫瘤免疫藥物!
日期:2021-11-10 10:18:50
繼PD-(L)1大獲成功之后,腫瘤免疫治療取得了革命性的成功,但腫瘤組織中浸潤了大量的免疫抑制性細胞,使得不同類型腫瘤患者對腫瘤免疫療法的應答率較低。對于實體瘤治療而言,為提高治療效果,最重要的方面是解除腫瘤微環境(TME)對免疫效應細胞的抑制作用。因此,開發出特異性靶向和清除腫瘤組織中浸潤的調節性T細胞(Tregs),是突破PD-1局限性的必然方向。
Tregs已被證明在腫瘤免疫中發揮重要作用,其主要功能是抑制自身反應性細胞介導的病理性免疫應答。隨著腫瘤相關Tregs標記物CTLA4和CCR4藥物的上市,CCR8的出現更是引起了廣泛的重視,CCR8這個過去幾乎無人問津的靶點走到了抗腫瘤新藥研發的前沿,點燃了各大制藥企業對它的研發熱情。
CCR8靶點的發光之旅
2020年9月1日,吉利德Gilead宣布以8.05億美元從Jounce Therapeutics獲得CCR8靶向抗體JTX-1811的合作開發權。正因這場不菲協議的達成,Jounce估價飆升了70%。與此同時,CCR8正式步入人們視野。
2020年9月2日,上海和鉑醫藥公司在第16屆蛋白質工程峰會(PEGS)以口頭匯報的形式,展示其針對CCR8靶點開發的單克隆抗體HBM1022,預期將于2022年提交HBM1022的臨床試驗申請(IND)申請;
2021年2月,Vaccinex宣布Surface Oncology獲得CCR8抗體(SRF114)開發的權益,當月,Surface Oncology的股價大幅上漲。目前,Surface Oncology市值達33億美元;
2021年2月,安進Amgen以19億美元收購Five Prime,以擴大腫瘤產品管線,Five Prime的產品就包括CCR8單抗FPA157,預計將在2022年上半年提交IND;
2021年5月,Bristol-Myers Squibb(BMS),啟動了一項CCR8靶向單克隆抗體BMS-986340的臨床試驗,以評估其與O類藥物聯合治療多種實體腫瘤的療效;
2021年8月,南京艾美斐醫藥宣布,自主研發的靶向CCR8小分子抑制劑(IPG7236)的IND獲得FDA批準。今年9月,艾美斐醫藥完成1億元A+輪融資,將用于IPG7236的I期臨床試驗的開展和商業化準備;
有理由相信,國內外生物制藥公司對CCR8的關注將持續上升。
CCR8靶點簡介
CCR8是趨化因子受體亞家族的成員之一,屬于G蛋白偶聯受體。人CCL1是CCR8的主要配體,其它配體有CCL8、CCL16和CCL18。CCR8在腫瘤浸潤的調節性T細胞(Treg)上特異性表達,在Th2細胞和腫瘤細胞也均有表達;然而在外周血Treg或正常組織上基本不表達。CCR8的主要作用是參與Tregs和Th2細胞向炎癥和腫瘤部位的募集。大量研究發現,高表達的CCR8與多種癌癥相關,包括結直腸癌、乳腺癌、胃癌、轉移性腦癌、轉移性肝癌,尤其是在乳腺癌分離的Tregs細胞上,所以近幾年研究人員的目光開始聚集在CCR8身上。
CCR8+Tregs在TME中的浸潤機制
在解釋該機制前,我們先了解一個概念,什么是調節性T細胞(Tregs)?Tregs是一種特殊的CD4陽性淋巴細胞亞群,具有免疫調節功能,能夠抑制過度和不受控制的免疫反應。最重要的是,Tregs通過抑制攻擊腫瘤的免疫細胞的免疫反應,在腫瘤免疫逃避中發揮關鍵作用。
具體看看CCR8+Tregs是如何在TME是發揮作用的,如圖1,腫瘤干細胞CAF和TAM分泌CCL1到TME中,與多種細胞上的CCR8結合并激活CCR8。CCR8-CCL1軸的作用主要包括:1. CCL1結合腫瘤細胞上的CCR8,引起腫瘤細胞增殖,遷移和抗細胞凋亡;2. CCL1結合血管內皮細胞上的CCR8,促血管生成以及腫瘤生長;3. CCL1結合CD4+T細胞上的CCR8,導致CD4+T細胞轉化為Tregs,再募集Tregs;4. CCL1結合Tregs上的CCR8,Tregs向炎癥或腫瘤部位募集。
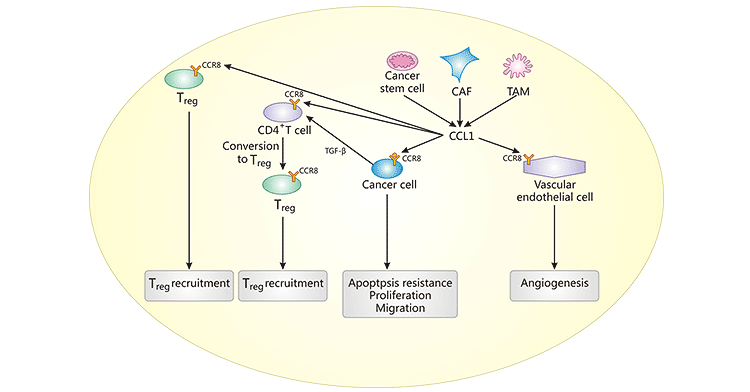
圖1. CCR8-CCL1軸的作用
CCR8-CCL1軸不僅將CCR8+Tregs招募到TME中,如圖2,CCR8-CCL1還可誘導對Tregs抑制至關重要的FOXP3和CD39,以及IL-10的上調,這將增強Treg的免疫抑制活性。研究發現,與正常組織中的Tregs相比,CCR8在人類乳腺癌的腫瘤浸潤性Tregs中顯著上調,表明CCR8是TME中Tregs上的一個有希望的治療靶點,而不會引起系統性自身免疫。因此,以CCR8為靶點的抗體,清除腫瘤微環境中的Treg細胞,將改善TME的免疫功能。
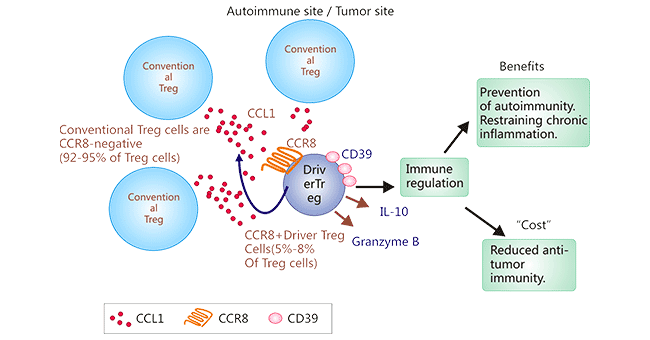
圖2. CCR8+Tregs在TME中的浸潤機制
CCR8靶點在研項目
截止目前,可查到信息的CCR8靶點在研項目有6個,這跟其研究尚在早期有關。國外藥企有吉利德、BMS、Five Prime(已被安進Amgen收購);國內,和鉑醫藥和艾美斐生物醫藥已開始布局。此外,通過專利檢索得到,國內一家普米斯生物關于CCR8已申請CCR8單抗和CCR8xCTLA-4雙抗2個專利。不難看出,CRR8將一個極具潛力的免疫治療靶點,未來我們或將看到更多的CCR8單抗或雙抗的藥企玩家。
| 藥物名稱 | 研發狀態 | 公司 | 治療領域/適應癥 | 最后更新日期 |
|---|---|---|---|---|
| JTX-1811 GS-1811 |
臨床一期 | Gilead Sciences Inc | 實體瘤 | 2021-08-26 |
| IPG-7236 | 臨床階段不明 | 南京艾美斐生物醫藥科技有限公司 | 實體瘤 | 2021-08-20 |
| SRF-114 | 臨床前 | Surface Oncology | 腫瘤 | 2021-08-24 |
| FPA-157 | 臨床前 | Five Prime Therapeutics Amgen | 實體瘤 | 2021-08-24 |
| HBM-1022 | 臨床前 | 和鉑醫藥 | 腫瘤 | 2021-08-24 |
| BMS-986340 | 臨床前 | Bristol-Myers Squibb Srl | 腫瘤 | 2021-08-24 |
數據來源藥渡
為鼎力協助各藥企在CCR8靶點上的研發,華美科賽博推出CCR8活性蛋白產品,歡迎聯系我們。
Recombinant Human CCR8-VLPs 活性蛋白實驗驗證數據
● 經WB驗證蛋白特異性
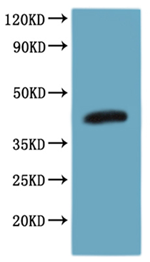
CSB-MP004847HU is detected by Mouse anti-6*His monoclonal antibody.
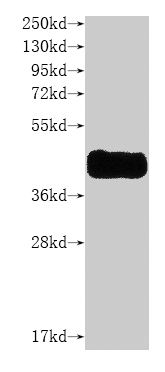
CSB-MP004847HU is detected by Anti-CCR8 recombinant Antibody
● 功能性ELISA驗證高活性
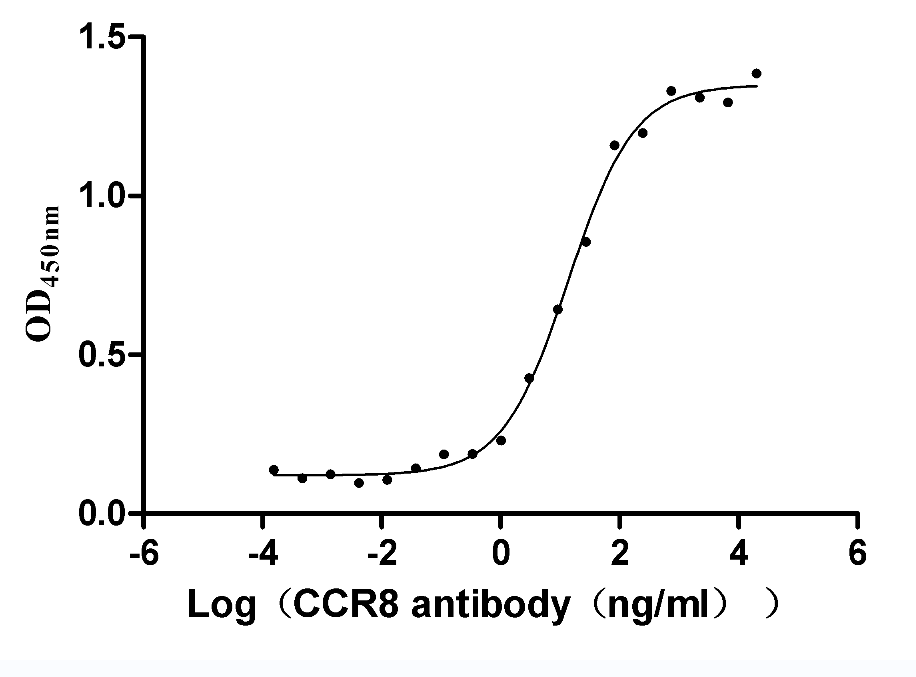
Immobilized human CCR8 at 5 μg/ml can bind Anti-CCR8 recombinant Antibody. The EC50 is 11.13-17.29 ng/mL.
● 經TEM驗證蛋白正確組裝
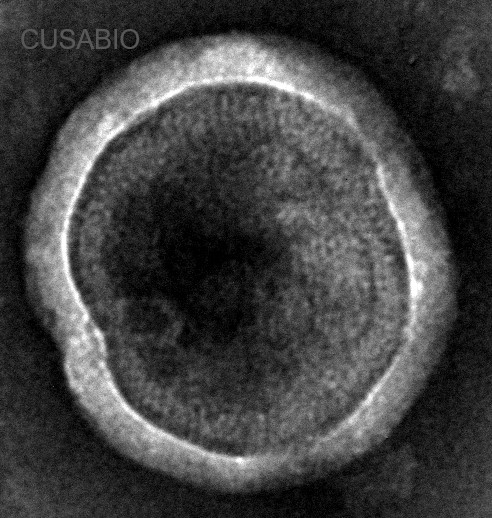
The VLP-like structures of CCR8 has been confirmed by TEM.
參考文獻:
[1] Karin, Nathan. "Chemokines and cancer: new immune checkpoints for cancer therapy. "Current opinion in immunology 51 (2018): 140-145.
[2] Das, Suvendu, et al. "Tumor cell entry into the lymph node is controlled by CCL1 chemokine expressed by lymph node lymphatic sinuses." journal of Experimental Medicine 210.8 (2013): 1509-1528.
[3] Whiteside, Sarah K., et al. "CCR8 marks highly suppressive Treg cells within tumours but is dispensable for their accumulation and suppressive function ." Immunology (2021).
[4] Roose, Heleen, et al. "Investigation of the best therapeutic approach to target CCR8 expressed on tumor regulatory T cells to boost anti-tumor immune responses." (2021): 1732-1732.
[5] Korbecki, Jan, et al. "CC chemokines in a tumor: a review of pro-cancer and anti-cancer properties of receptors CCR5, CCR6, CCR7, CCR8, CCR9, and CCR10 ligands." international journal of molecular sciences 21.20 (2020): 7619.










