【35期】前沿靶點速遞:每周醫(yī)學研究精選
日期:2025-04-08 14:06:57
01.靶點 VPS35
應用:胃癌和癌癥耐藥性領(lǐng)域
來源:Oxidation of retromer complex controls mitochondrial translation.Nature,2025 Mar 26
近日,《Nature》發(fā)表了一項關(guān)于 Retromer 復合物的研究,揭示了其核心蛋白 VPS35 的氧化狀態(tài)對線粒體功能的調(diào)控作用。研究發(fā)現(xiàn),VPS35 蛋白能夠感知細胞內(nèi)的氧化水平,并通過氧化修飾影響 Retromer 復合物的活性,從而調(diào)控線粒體翻譯效率。在耐藥癌細胞中,VPS35 的氧化水平顯著降低,導致線粒體功能增強,為癌細胞提供額外能量以抵抗化療藥物。通過實驗,研究人員發(fā)現(xiàn)人為提高 VPS35 的氧化水平可以逆轉(zhuǎn)癌細胞的耐藥性,增強化療藥物的殺傷效果。這一發(fā)現(xiàn)為克服癌癥耐藥性提供了新的潛在靶點,也為開發(fā)新型抗癌療法帶來希望。
02.靶點 CBLB
應用:肝纖維化
來源:Revisiting the Role of CBL in Liver Fibrosis: Unveiling the Antifibrotic Potential of CBLB Inhibitor NX-1607.J Hepatol,2025 Mar 25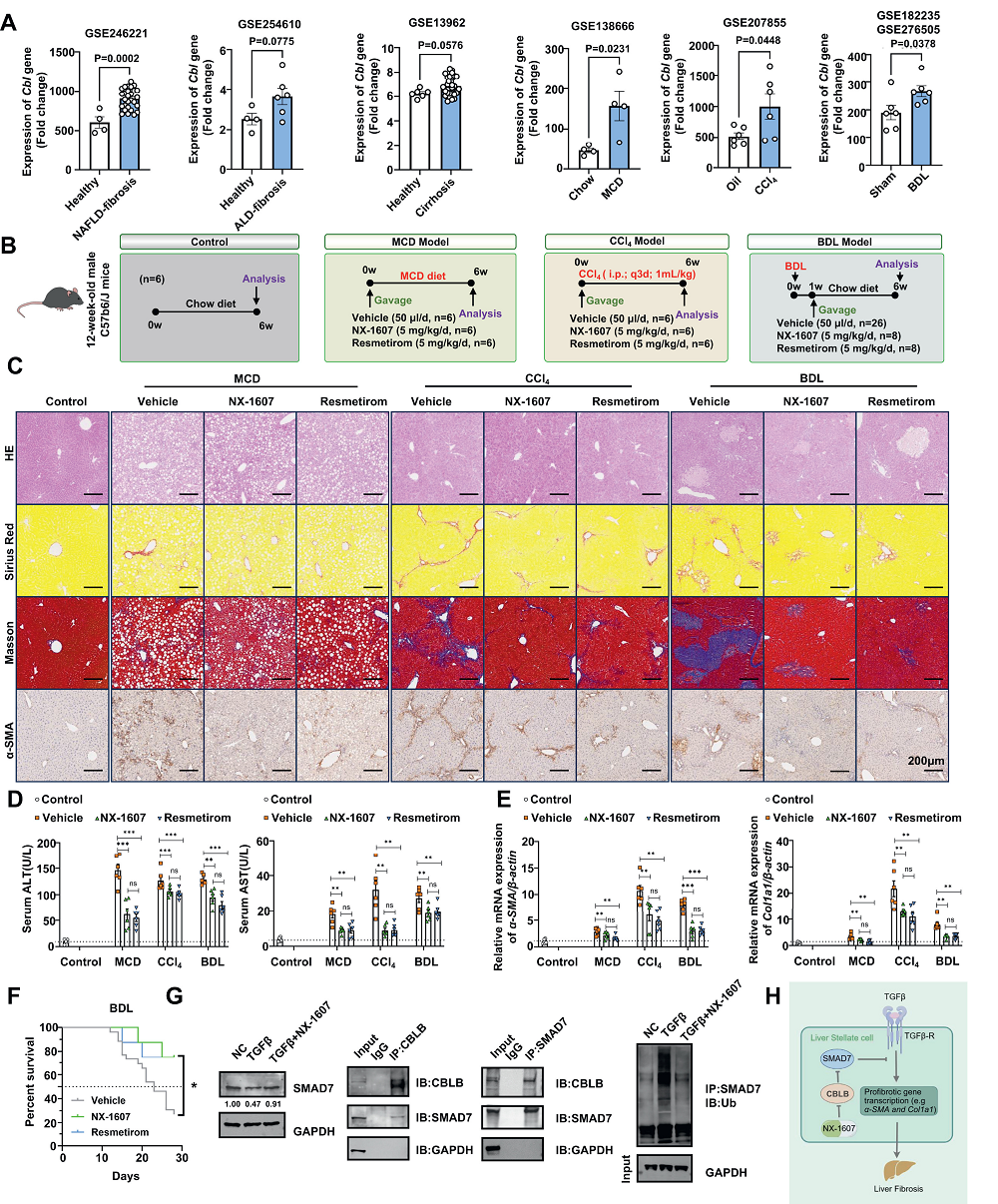
近日,北京大學心血管研究所冼勛德課題組在《Journal of Hepatology》發(fā)表研究,揭示了CBLB在肝纖維化中的作用,并發(fā)現(xiàn)其小分子抑制劑NX-1607可顯著緩解肝纖維化。研究基于臨床轉(zhuǎn)錄組數(shù)據(jù)庫分析發(fā)現(xiàn),肝纖維化患者Cbl基因表達升高。通過多種小鼠肝纖維化模型實驗,NX-1607被證實能減少肝組織纖維化,降低纖維化標志物表達,并改善模型小鼠生存率。機制上,CBLB通過促進SMAD7泛素化降解增強TGF-β信號,激活肝星狀細胞。NX-1607通過抑制CBLB,穩(wěn)定SMAD7,減弱TGF-β信號,減少細胞外基質(zhì)沉積。該研究挑戰(zhàn)了CBL在肝纖維化中的保護性作用假設,為肝纖維化治療提供了新靶點和潛在藥物。
03.靶點 ZDHHC8
應用:鐵死亡抵抗型及免疫治療耐藥性實體腫瘤
來源:Palmitoylation of GPX4 via the targetable ZDHHC8 determines ferroptosis sensitivity and antitumour immunity.Nat Cancer,2025 Mar 19
中山大學崔雋教授團隊在《Nature Cancer》發(fā)表研究,揭示了棕櫚酰基轉(zhuǎn)移酶zDHHC8在腫瘤鐵死亡抵抗中的關(guān)鍵作用。zDHHC8在多種腫瘤中高表達,通過棕櫚酰化修飾GPX4幫助腫瘤細胞抵抗鐵死亡。研究團隊開發(fā)的小分子化合物PF-670462能特異性結(jié)合并降解zDHHC8,解除GPX4的棕櫚酰化修飾。實驗表明,PF-670462顯著增強了腫瘤細胞對鐵死亡的敏感性,促進了CD8+ T細胞浸潤,并與抗PD-1免疫治療聯(lián)用時顯著延長小鼠生存期。這一發(fā)現(xiàn)不僅揭示了腫瘤免疫逃逸的新機制,還提供了克服耐藥性的新策略,有望應用于多種高耐藥性腫瘤的治療。
04.靶點 TAOK1
應用:針對PARP抑制劑耐藥性腫瘤
來源:TAOK1 promotes filament formation in HR repair through phosphorylating USP7.Proc Natl Acad Sci U S A,2025 Mar 25
謝丹/蔡木炎團隊在PNAS發(fā)表研究,揭示了TAOK1通過磷酸化USP7調(diào)控同源重組(HR)修復的分子機制。研究發(fā)現(xiàn),TAOK1抑制劑與PARP抑制劑具有協(xié)同抗腫瘤效應。TAOK1通過磷酸化USP7的S255位點,激活其去泛素化酶活性,維持HR修復關(guān)鍵蛋白RAD51的穩(wěn)定性,促進HR修復過程中的絲狀結(jié)構(gòu)形成。敲除或藥物抑制TAOK1可顯著增加腫瘤細胞對PARP抑制劑的敏感性,提高治療效果。這一發(fā)現(xiàn)為擴展PARP抑制劑的適用人群和提升其療效提供了新策略,TAOK1有望成為預測PARP抑制劑療效的生物標志物,指導臨床精準治療。
05.靶點 TMEM63B
應用:體液代謝失衡相關(guān)疾病?
來源:TMEM63B functions as a mammalian hyperosmolar sensor for thirst.Neuron,2025 Mar 11
06.靶點 FBXW7
應用:實體瘤(尤其胰腺癌、肺癌、卵巢癌)?
來源:The FBXW7-KMT2 axis in cancer-associated fibroblasts controls tumor growth via an epigenetic-paracrine mechanism.Proc Natl Acad Sci U S A,2025 Apr
孫毅團隊在《PNAS》發(fā)表研究,揭示了FBXW7在腫瘤微環(huán)境(TME)中的腫瘤抑制新機制。研究發(fā)現(xiàn),F(xiàn)BXW7在腫瘤相關(guān)成纖維細胞(CAFs)中表達減少,與腫瘤惡性程度增加相關(guān)。FBXW7通過與KMT2復合物成員RbBP5結(jié)合,競爭性抑制KMT2復合物的活性,降低H3K4甲基化水平,從而抑制IL-17信號通路基因的表達。FBXW7的缺失會增強KMT2活性,上調(diào)H3K4甲基化,促進細胞因子和趨化因子分泌,進而通過旁分泌途徑促進腫瘤生長。此外,低氧條件下,ETS1上調(diào)導致FBXW7表達降低,激活I(lǐng)L-17信號通路,促進癌細胞遷移和侵襲。這一研究為通過靶向FBXW7-KMT2軸調(diào)控腫瘤微環(huán)境提供了理論依據(jù)。
07.靶點 MTCH2
應用:肥胖及相關(guān)代謝性疾病
來源:MTCH2 suppresses thermogenesis by regulating autophagy in adipose tissue.Adv Sci (Weinh),2025 Mar 07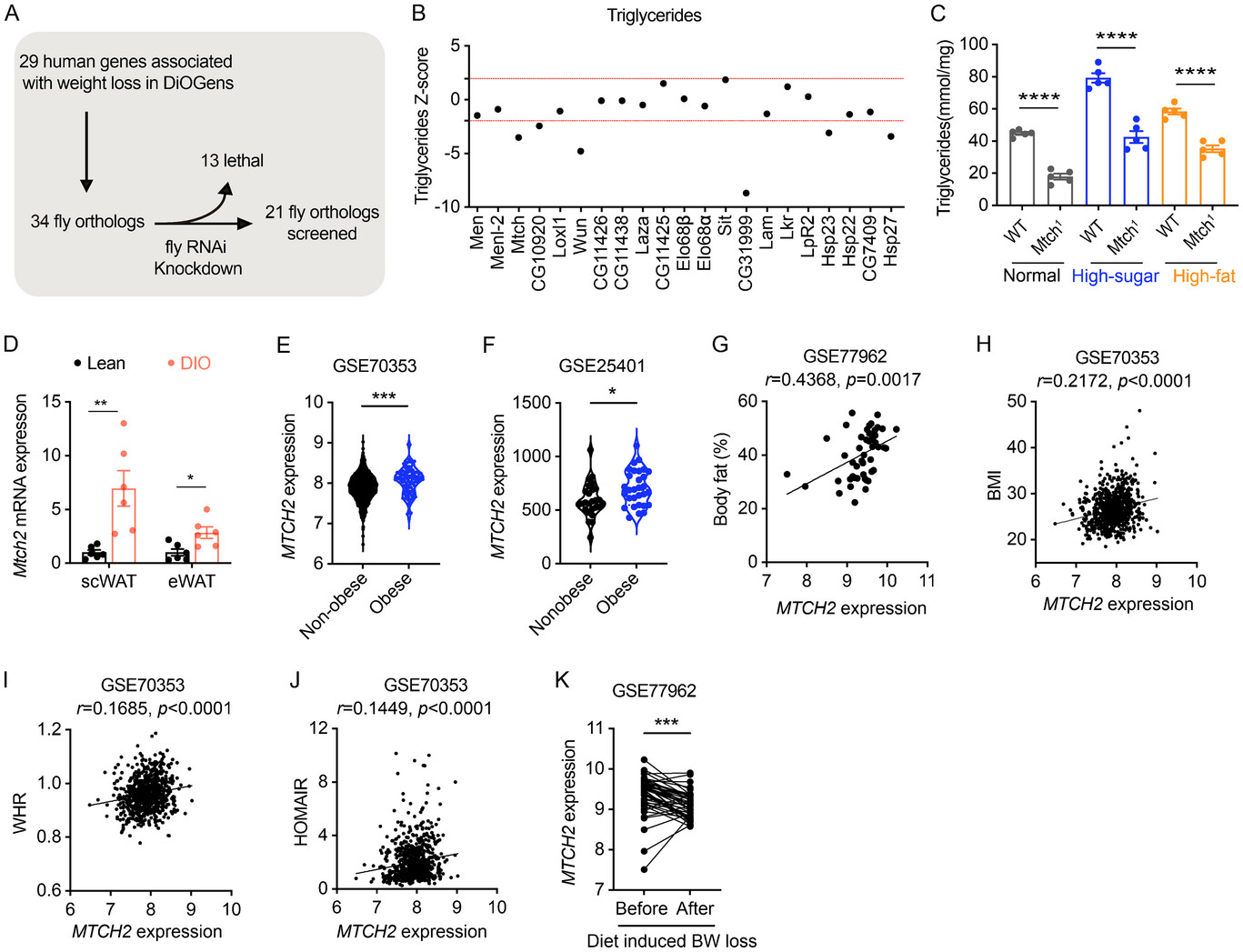
王巧平、Greg Neely和石雁川團隊合作在《Advanced Science》發(fā)表研究,揭示了MTCH2作為脂肪組織產(chǎn)熱和能量平衡的關(guān)鍵負調(diào)控因子。研究發(fā)現(xiàn),MTCH2在脂肪組織中表達水平與肥胖及代謝紊亂呈正相關(guān)。通過構(gòu)建脂肪組織特異性Mtch2敲除小鼠模型,研究發(fā)現(xiàn)Mtch2缺失可增強棕色脂肪組織產(chǎn)熱和白色脂肪棕色化,增加能量消耗。機制上,Mtch2通過Bcl-2介導的自噬過程調(diào)控能量代謝。這一發(fā)現(xiàn)不僅完善了脂肪組織產(chǎn)熱調(diào)控的理論體系,也為肥胖治療提供了新的潛在靶點。
08.靶點 RUVBL2
應用:晝夜節(jié)律紊亂、代謝性疾病、MYC驅(qū)動型腫瘤
來源:The P-loop NTPase RUVBL2 is a conserved clock component across eukaryotes.Nature,2025 Mar 26
張二荃實驗室在《Nature》發(fā)表研究,揭示RUVBL2作為真核生物鐘的核心組分,其低ATP酶活性調(diào)控晝夜節(jié)律。RUVBL2在多種生物中高度保守,與藍藻KaiC的ATP水解速率相當,可能通過類似機制維持24小時周期震蕩。這一發(fā)現(xiàn)挑戰(zhàn)了傳統(tǒng)的轉(zhuǎn)錄-翻譯負反饋環(huán)路(TTFL)理論,為生物鐘的起源和進化提供了新的視角。
09.靶點 ALKBH5
應用:急性髓系白血病(AML)和三陰性乳腺癌(TNBC)
來源:Discovery of Covalent and Cell‐Active ALKBH5 Inhibitors with Potent Antileukemia Effects In Vivo.Angew Chem Int Ed Engl,2025 Feb 20
中科院上海藥物所柳紅、楊財廣團隊在《Angewandte Chemie International Edition》發(fā)表研究,發(fā)現(xiàn)靶向ALKBH5 Cys200的共價抑制劑18l。該抑制劑通過共價修飾Cys200阻止底物結(jié)合,表現(xiàn)出強效的ALKBH5抑制活性和選擇性,在體外和體內(nèi)研究中顯示出優(yōu)秀的抗急性髓系白血病(AML)作用。研究團隊通過多種化學生物學手段驗證了其作用機制,為RNA表觀遺傳領(lǐng)域的精準化學調(diào)控提供了新的指導思路。
10.靶點 HLA-DRB1
應用:急性髓系白血病(AML)
來源: CAR T or NK cells targeting mismatched HLA-DR molecules in acute myeloid leukemia after allogeneic hematopoietic stem cell transplant.Nat Cancer,2025 Mar 24
大阪大學研究人員在《Nature Cancer》發(fā)表論文,發(fā)現(xiàn)新型急性髓系白血病(AML)特異性靶點HLA-DRB1,并開發(fā)了KG2032 CAR-T/NK細胞療法。該療法通過靶向特定HLA-DRB1亞型,在不影響正常造血細胞的情況下精準殺傷AML細胞。小鼠實驗驗證了其療效與安全性,為AML免疫治療提供了新思路。未來,研究人員計劃開發(fā)針對不同HLA-DRB1子集的抗體,以擴大治療適用范圍并提高療效和安全性。
產(chǎn)品推薦
*免責聲明:華美生物內(nèi)容團隊僅是分享和解讀公開研究論文及其發(fā)現(xiàn),本文僅作信息交流,文中觀點不代表華美生物立場,請理解。
應用:胃癌和癌癥耐藥性領(lǐng)域
來源:Oxidation of retromer complex controls mitochondrial translation.Nature,2025 Mar 26

圖源:10.1038/s41586-025-08756-y
近日,《Nature》發(fā)表了一項關(guān)于 Retromer 復合物的研究,揭示了其核心蛋白 VPS35 的氧化狀態(tài)對線粒體功能的調(diào)控作用。研究發(fā)現(xiàn),VPS35 蛋白能夠感知細胞內(nèi)的氧化水平,并通過氧化修飾影響 Retromer 復合物的活性,從而調(diào)控線粒體翻譯效率。在耐藥癌細胞中,VPS35 的氧化水平顯著降低,導致線粒體功能增強,為癌細胞提供額外能量以抵抗化療藥物。通過實驗,研究人員發(fā)現(xiàn)人為提高 VPS35 的氧化水平可以逆轉(zhuǎn)癌細胞的耐藥性,增強化療藥物的殺傷效果。這一發(fā)現(xiàn)為克服癌癥耐藥性提供了新的潛在靶點,也為開發(fā)新型抗癌療法帶來希望。
02.靶點 CBLB
應用:肝纖維化
來源:Revisiting the Role of CBL in Liver Fibrosis: Unveiling the Antifibrotic Potential of CBLB Inhibitor NX-1607.J Hepatol,2025 Mar 25

圖源:10.1016/j.jhep.2025.03.023
近日,北京大學心血管研究所冼勛德課題組在《Journal of Hepatology》發(fā)表研究,揭示了CBLB在肝纖維化中的作用,并發(fā)現(xiàn)其小分子抑制劑NX-1607可顯著緩解肝纖維化。研究基于臨床轉(zhuǎn)錄組數(shù)據(jù)庫分析發(fā)現(xiàn),肝纖維化患者Cbl基因表達升高。通過多種小鼠肝纖維化模型實驗,NX-1607被證實能減少肝組織纖維化,降低纖維化標志物表達,并改善模型小鼠生存率。機制上,CBLB通過促進SMAD7泛素化降解增強TGF-β信號,激活肝星狀細胞。NX-1607通過抑制CBLB,穩(wěn)定SMAD7,減弱TGF-β信號,減少細胞外基質(zhì)沉積。該研究挑戰(zhàn)了CBL在肝纖維化中的保護性作用假設,為肝纖維化治療提供了新靶點和潛在藥物。
03.靶點 ZDHHC8
應用:鐵死亡抵抗型及免疫治療耐藥性實體腫瘤
來源:Palmitoylation of GPX4 via the targetable ZDHHC8 determines ferroptosis sensitivity and antitumour immunity.Nat Cancer,2025 Mar 19

圖源:10.1038/s43018-025-00937-y
中山大學崔雋教授團隊在《Nature Cancer》發(fā)表研究,揭示了棕櫚酰基轉(zhuǎn)移酶zDHHC8在腫瘤鐵死亡抵抗中的關(guān)鍵作用。zDHHC8在多種腫瘤中高表達,通過棕櫚酰化修飾GPX4幫助腫瘤細胞抵抗鐵死亡。研究團隊開發(fā)的小分子化合物PF-670462能特異性結(jié)合并降解zDHHC8,解除GPX4的棕櫚酰化修飾。實驗表明,PF-670462顯著增強了腫瘤細胞對鐵死亡的敏感性,促進了CD8+ T細胞浸潤,并與抗PD-1免疫治療聯(lián)用時顯著延長小鼠生存期。這一發(fā)現(xiàn)不僅揭示了腫瘤免疫逃逸的新機制,還提供了克服耐藥性的新策略,有望應用于多種高耐藥性腫瘤的治療。
04.靶點 TAOK1
應用:針對PARP抑制劑耐藥性腫瘤
來源:TAOK1 promotes filament formation in HR repair through phosphorylating USP7.Proc Natl Acad Sci U S A,2025 Mar 25

圖源:10.1073/pnas.2422262122
謝丹/蔡木炎團隊在PNAS發(fā)表研究,揭示了TAOK1通過磷酸化USP7調(diào)控同源重組(HR)修復的分子機制。研究發(fā)現(xiàn),TAOK1抑制劑與PARP抑制劑具有協(xié)同抗腫瘤效應。TAOK1通過磷酸化USP7的S255位點,激活其去泛素化酶活性,維持HR修復關(guān)鍵蛋白RAD51的穩(wěn)定性,促進HR修復過程中的絲狀結(jié)構(gòu)形成。敲除或藥物抑制TAOK1可顯著增加腫瘤細胞對PARP抑制劑的敏感性,提高治療效果。這一發(fā)現(xiàn)為擴展PARP抑制劑的適用人群和提升其療效提供了新策略,TAOK1有望成為預測PARP抑制劑療效的生物標志物,指導臨床精準治療。
05.靶點 TMEM63B
應用:體液代謝失衡相關(guān)疾病?
來源:TMEM63B functions as a mammalian hyperosmolar sensor for thirst.Neuron,2025 Mar 11

圖源:10.1016/j.neuron.2025.02.012
首都醫(yī)科大學閆致強教授團隊在《Neuron》發(fā)表研究,揭示了TMEM63B作為哺乳動物高滲感受器的關(guān)鍵作用。研究發(fā)現(xiàn),TMEM63B在感知血液高滲狀態(tài)時發(fā)揮重要作用,其在穹窿下器官興奮性神經(jīng)元中特異性高表達。TMEM63B敲除可顯著抑制高滲刺激下的神經(jīng)元反應,而純化的TMEM63B蛋白在脂質(zhì)體中可形成高滲激活的離子通道。利用基因編輯技術(shù)構(gòu)建的TMEM63B敲除小鼠模型,在高滲或脫水條件下表現(xiàn)出顯著的口渴行為缺陷。這一發(fā)現(xiàn)不僅為理解口渴的神經(jīng)生物學機制提供了關(guān)鍵的分子基礎(chǔ),還為高血壓、尿崩癥等疾病的治療提供了新思路。06.靶點 FBXW7
應用:實體瘤(尤其胰腺癌、肺癌、卵巢癌)?
來源:The FBXW7-KMT2 axis in cancer-associated fibroblasts controls tumor growth via an epigenetic-paracrine mechanism.Proc Natl Acad Sci U S A,2025 Apr

圖源:10.1073/pnas.2423130122
孫毅團隊在《PNAS》發(fā)表研究,揭示了FBXW7在腫瘤微環(huán)境(TME)中的腫瘤抑制新機制。研究發(fā)現(xiàn),F(xiàn)BXW7在腫瘤相關(guān)成纖維細胞(CAFs)中表達減少,與腫瘤惡性程度增加相關(guān)。FBXW7通過與KMT2復合物成員RbBP5結(jié)合,競爭性抑制KMT2復合物的活性,降低H3K4甲基化水平,從而抑制IL-17信號通路基因的表達。FBXW7的缺失會增強KMT2活性,上調(diào)H3K4甲基化,促進細胞因子和趨化因子分泌,進而通過旁分泌途徑促進腫瘤生長。此外,低氧條件下,ETS1上調(diào)導致FBXW7表達降低,激活I(lǐng)L-17信號通路,促進癌細胞遷移和侵襲。這一研究為通過靶向FBXW7-KMT2軸調(diào)控腫瘤微環(huán)境提供了理論依據(jù)。
07.靶點 MTCH2
應用:肥胖及相關(guān)代謝性疾病
來源:MTCH2 suppresses thermogenesis by regulating autophagy in adipose tissue.Adv Sci (Weinh),2025 Mar 07

圖源:10.1002/advs.202416598
王巧平、Greg Neely和石雁川團隊合作在《Advanced Science》發(fā)表研究,揭示了MTCH2作為脂肪組織產(chǎn)熱和能量平衡的關(guān)鍵負調(diào)控因子。研究發(fā)現(xiàn),MTCH2在脂肪組織中表達水平與肥胖及代謝紊亂呈正相關(guān)。通過構(gòu)建脂肪組織特異性Mtch2敲除小鼠模型,研究發(fā)現(xiàn)Mtch2缺失可增強棕色脂肪組織產(chǎn)熱和白色脂肪棕色化,增加能量消耗。機制上,Mtch2通過Bcl-2介導的自噬過程調(diào)控能量代謝。這一發(fā)現(xiàn)不僅完善了脂肪組織產(chǎn)熱調(diào)控的理論體系,也為肥胖治療提供了新的潛在靶點。
08.靶點 RUVBL2
應用:晝夜節(jié)律紊亂、代謝性疾病、MYC驅(qū)動型腫瘤
來源:The P-loop NTPase RUVBL2 is a conserved clock component across eukaryotes.Nature,2025 Mar 26

圖源:10.1038/s41586-025-08797-3
張二荃實驗室在《Nature》發(fā)表研究,揭示RUVBL2作為真核生物鐘的核心組分,其低ATP酶活性調(diào)控晝夜節(jié)律。RUVBL2在多種生物中高度保守,與藍藻KaiC的ATP水解速率相當,可能通過類似機制維持24小時周期震蕩。這一發(fā)現(xiàn)挑戰(zhàn)了傳統(tǒng)的轉(zhuǎn)錄-翻譯負反饋環(huán)路(TTFL)理論,為生物鐘的起源和進化提供了新的視角。
09.靶點 ALKBH5
應用:急性髓系白血病(AML)和三陰性乳腺癌(TNBC)
來源:Discovery of Covalent and Cell‐Active ALKBH5 Inhibitors with Potent Antileukemia Effects In Vivo.Angew Chem Int Ed Engl,2025 Feb 20

圖源:10.1002/anie.202424928
中科院上海藥物所柳紅、楊財廣團隊在《Angewandte Chemie International Edition》發(fā)表研究,發(fā)現(xiàn)靶向ALKBH5 Cys200的共價抑制劑18l。該抑制劑通過共價修飾Cys200阻止底物結(jié)合,表現(xiàn)出強效的ALKBH5抑制活性和選擇性,在體外和體內(nèi)研究中顯示出優(yōu)秀的抗急性髓系白血病(AML)作用。研究團隊通過多種化學生物學手段驗證了其作用機制,為RNA表觀遺傳領(lǐng)域的精準化學調(diào)控提供了新的指導思路。
10.靶點 HLA-DRB1
應用:急性髓系白血病(AML)
來源: CAR T or NK cells targeting mismatched HLA-DR molecules in acute myeloid leukemia after allogeneic hematopoietic stem cell transplant.Nat Cancer,2025 Mar 24

圖源:10.1038/s43018-025-00934-1
大阪大學研究人員在《Nature Cancer》發(fā)表論文,發(fā)現(xiàn)新型急性髓系白血病(AML)特異性靶點HLA-DRB1,并開發(fā)了KG2032 CAR-T/NK細胞療法。該療法通過靶向特定HLA-DRB1亞型,在不影響正常造血細胞的情況下精準殺傷AML細胞。小鼠實驗驗證了其療效與安全性,為AML免疫治療提供了新思路。未來,研究人員計劃開發(fā)針對不同HLA-DRB1子集的抗體,以擴大治療適用范圍并提高療效和安全性。
產(chǎn)品推薦
| 靶點 | 重組蛋白 | 貨號 |
| ALKBH5 | Recombinant Human Probable alpha-ketoglutarate-dependent dioxygenase ABH5 (ALKBH5) | CSB-EP744062HU |
| CBLB | Recombinant Human E3 ubiquitin-protein ligase CBL-B (CBLB), partial | CSB-MP623789HU |
| FBXW7 | Recombinant Human F-box/WD repeat-containing protein 7 (FBXW7) | CSB-CF822163HU |
| HLA-DRB1 | Recombinant Human HLA class II histocompatibility antigen, DRB1 beta chain (HLA-DRB1), partial | CSB-EP361230HU |
| MTCH2 | Recombinant Human Mitochondrial carrier homolog 2 (MTCH2), partial | CSB-MP897586HU1 |
| RUVBL2 | Recombinant Human RuvB-like 2 (RUVBL2) | CSB-EP897459HU |
| TAOK1 | Recombinant Human Serine/threonine-protein kinase TAO1 (TAOK1), partial | CSB-MP752101HU |
| TMEM63B | Recombinant Human Transmembrane protein 63B (TMEM63B), partial | CSB-MP023866HU |
| VPS35 | Recombinant Human Vacuolar protein sorting-associated protein 35 (VPS35) | CSB-BP839401HUd8 |
| ZDHHC8 | Recombinant Human Probable palmitoyltransferase ZDHHC8 (ZDHHC8), partial | CSB-MP890747HU1 |
*免責聲明:華美生物內(nèi)容團隊僅是分享和解讀公開研究論文及其發(fā)現(xiàn),本文僅作信息交流,文中觀點不代表華美生物立場,請理解。










