CCR9: 趨化因子受體家族成員,眾多腫瘤研究的新興靶點!
日期:2024-01-19 11:26:22
越來越多的研究指出,趨化因子受體作為G蛋白偶聯受體的一類,與趨化因子相互作用,不僅在機體正常生長發育過程中起作用,還參與炎癥反應、免疫及癌癥等多種疾病的發生發展。當前,一些熱門的趨化因子受體在臨床研究中被廣泛關注,諸如CXCR2、CXCR4、CXCR5、CCR5、CCR6、CCR7、CCR8、CCR10等等。隨著研究的廣泛深入,更多新的趨化因子及受體被發現,CC族趨化因子受體9(CCR9),同樣作為7次跨膜結構的趨化因子受體G蛋白偶聯受體,在調節人體免疫細胞發生發展、分化,以及引導白細胞的定向遷移等生理調節過程中發揮作用。近期,對CC族趨化因子受體9的研究逐漸成為腫瘤領域的熱點之一。今天讓我們一起了解下趨化因子受體CCR9!
1. 什么是CCR9?
1.1 CCR9的結構
CC族趨化因子受體9(CC chemokine receptor 9,CCR9)屬于趨化因子受體家族中的一員,是具有7次跨膜結構的G蛋白偶聯受體。趨化因子受體家族是一類重要的細胞表面受體,與趨化因子結合后可以調控細胞的運動、分化、增殖等多種功能。趨化因子受體可分為四個亞家族,分別是CC、CXC、CX3C和C型。其中CCR9屬于CC亞家族(點擊查看趨化因子家族介紹)。CCR9由轉錄物A(369個氨基酸,42 kDa)和轉錄物B(357個氨基酸,40.8 kDa)組成,由于其與CCR6和CCR7在結構和序列上相似,因而被重新命名為CCR9。CCR9發揮生理學功能的區域主要是由65~317個氨基酸組成的7次跨膜結構(圖1) [1-3]。
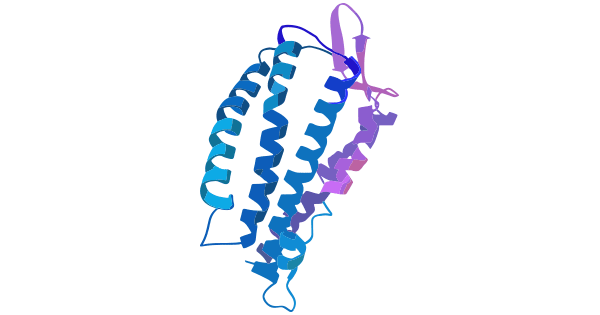
圖1. CCR9分子結構 [1]
1.2 CCR9的表達和功能
CCR9主要表達于未成熟胸腺細胞、外周血CD8+T、部分樹突狀細胞及小腸內皮細胞,可調節機體內環境平衡。受體CCR9與配體CCL25相互作用介導胸腺發育過程中未成熟細胞的遷移以及腸道相關免疫細胞的歸巢。研究顯示CCR9在多種疾病中扮演關鍵角色,如炎癥性腸病、急性肝炎、類風濕性關節炎。此外,大量證據表明CCR9在多種惡性腫瘤中異常高表達,這種高表達往往與腫瘤的耐藥、轉移及不良預后相關,提示CCR9可能參與了多種與腫瘤進展相關的生物學活動,包括結腸癌、黑色素瘤、前列腺癌、非小細胞肺癌等 [1-6]。
2. 什么是CCR9的配體?
CCR9的特定配體是胸腺表達趨化因子(Thymus Expressed Chemokine,TECK)/CCL25。CCL25位于19號染色體p13.2,屬于CC趨化因子家族。它由150個氨基酸組成,其中端的23個氨基酸為信號肽。CCL25主要表達于胸腺和小腸上皮細胞,還可少量表達于睪丸、腦組織、肝臟和活化的proT細胞。隨著腫瘤分子生物的深入研究,CCR9及其唯一的天然趨化因子配體CCL25在腫瘤中的調控作用逐漸被揭露 [7-10]。
研究數據表明血清CCL25與MMP-9、VEGF-D和AKT均高度相關,提示PI3K/AKT通路激活及其下游的效應細胞因子(VEGF-D和MMP-9)的表達有可能受CCR9/CCL25生物軸調節。此外,放線菌酮(cycloheximide,CHX)誘導的MOLT4細胞凋亡可被CCR9/CCL25信號通路抑制。CCL25與CCR9結合后,可啟動下游信號通路,活化PI3K并進一步磷酸化AKT。AKT的激活可促進Bad、GSK-3 β等多種參與細胞存活的信號分子的活化,從而促進細胞生存。因此,CCR9和配體CCL25有可能成為癌癥研究的靶向分子 [7-10]。
3. CCR9/CCL25在腫瘤中的信號調控機制
3.1 CCR9/CCL25和PI3K/AKT信號通路
PI3K-Akt信號通路是細胞內重要的信號傳導途徑之一,大量研究表明,PI3K-Akt信號通路與多種人類腫瘤的發生、發展及惡性進展密切相關。該通路受腫瘤相關基因PTEN、CTMP、SHLP2等內源性負調控。近期研究發現CCR9/CCL25生物軸能夠激活PI3K/AKT信號通路。研究指出CCR9/CCL25激活PI3K/AKT信號通路參與非小細胞肺癌細胞的抗凋亡過程,調節前列腺細胞的抗凋亡機制,并且抑制化療藥物依托泊苷(Etoposide)誘導的前列腺癌細胞凋亡。在乳腺癌和卵巢癌的研究中,CCR9/CCL25相互作用也抑制了化療藥物誘導的腫瘤細胞凋亡。這些研究提示,CCR9/CCL25可能通過PI3K/AKT信號通路調控腫瘤細胞凋亡(圖2) [1, 11-13]。
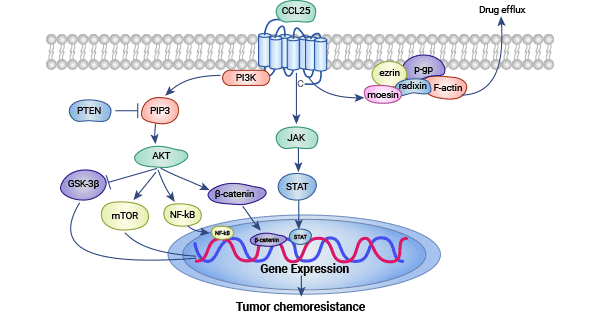
圖2. CCR9/CCL25和PI3K/AKT信號通路 [1]
3.2 CCR9/CCL25和JAK/STAT信號通路
JAK/STAT信號通路是一條快速、高效的從細胞外到細胞核的信號轉導通路。近年來的研究發現,JAK/STAT通路的激活,特別是STAT3的激活,對細胞的生長、增殖和轉化具有重要影響。T細胞介導的免疫治療是一種有效的腫瘤治療手段,但其主要限制是體內產生抗腫瘤細胞毒性作用的能力較弱。研究發現,CCR9通過STAT信號通路介導CCR9削弱細胞毒性效應作用。而抑制體內CCR9表達可以顯著改善腫瘤特異性T細胞介導免疫治療的效果。因此,進一步研究CCR9/CCL25與JAK/STAT信號通路之間的關系,對于探索新的腫瘤免疫研究方法具有重要意義 [6, 14-15]。
4. CCR9在腫瘤中的相關研究
在惡性腫瘤中,趨化因子與其受體結合參與疾病發生發展的所有階段,包括淋巴細胞募集、新血管生成、腫瘤增殖、存活以及腫瘤細胞侵襲和轉移。大量的研究證明,CCR9和CCL25在多種癌癥中高度表達,在腫瘤的侵襲、遷移、耐藥和抗調亡中發揮著重要作用,是一個潛在的腫瘤靶向研究突破點。
4.1 CCR9和T淋巴細胞白血病研究
在T淋巴細胞白血病中,CCR9在急性T淋巴細胞白血病(TALL)和慢性T淋巴細胞白血病(TCLL)的CD4+陽性T細胞中高表達,但在正常CD4+陽性T細胞中不表達。這可能與細胞增殖、存活以及逃避調控相關。研究指出,CCR9和CCL25的相互作用會影響叉頭轉錄因子(FKHR)和糖原合成酶激酶-3β(GSK-3β)的活化,從而抑制細胞凋亡信號通路,抑制惡性腫瘤細胞的凋亡 [16-17]。
另外,CCR9-CCL25在不同類型的T淋巴細胞中表現出不同作用,對CD4+CD8+雙陽性T淋巴細胞促進細胞發育和穩態維持,而對TALL CD4+陽性T淋巴細胞,則促進細胞異常增殖和抑制凋亡 [17]。此外,研究還發現CCR9可能通過Notch1信號途徑調節白血病細胞的生物學機制,而CCL25可能通過調控凋亡抑制蛋白Livin的水平影響白血病T淋巴細胞的生長和凋亡 [18]。
4.2 CCR9和結腸癌研究
CCL25在小腸和結腸上皮細胞中高度表達。它與CCR9陽性T淋巴細胞結合后,促使這些細胞進行定向轉運。因此,在消化系統中,CCR9-CCL25生物軸起著重要作用。結直腸癌研究表明,CCR9在腺癌和侵襲前結直腸癌細胞中顯著高于侵襲性和轉移性結直腸癌。盡管存在細胞表達狀態未完全驗證的情況,但已確定CCR9在結直腸癌中高表達。體外研究也證實,CCR9-CCL25軸能夠顯著促進結腸癌細胞的侵襲能力。因此,目前研究顯示CCR9/CL25在結腸癌中高表達,與該癌癥的發展和侵襲過程密切相關 [9, 19]。
4.3 CCR9和前列腺癌研究
CCR9/CCL25在前列腺癌中的研究較早,CCR9在前列腺淋巴結癌細胞系、前列腺癌細胞系和正常前列腺上皮細胞中的表達呈遞減梯度分布,其中在前列腺淋巴結癌細胞系中的表達量最高。提示CCR9/CCL25生物軸與前列腺癌淋巴結轉移關系密切。此外,CCR9/CCL25相互作用調節抗凋亡信號蛋白的活性,在CCL25存在的環境中,依托泊苷誘導的腫瘤細胞凋亡被顯著抑制,使用CCR9拮抗劑阻斷CCR9/CCL25途徑后,這種抑制細胞凋亡的作用被消除。因此,CCR9的高表達與前列腺腫瘤細胞的遷移和侵襲有關,抑制CCR9/CCL25的相互作用,可有效降低前列腺癌細胞的遷移和侵襲能力 [20-21]。
4.4 CCR9和卵巢癌研究
研究通過組織芯片結合免疫組織化學法檢測上皮性卵巢癌組織中CCR9表達情況,并分析其與患者臨床病理特征的關系。結果發現,較正常卵巢組織比較,CCR9和CCL25在上皮性卵巢癌中高表達,且與淋巴結轉移陽性、組織學分級和臨床分期關系密切。CCR9在卵巢癌組織中高表達,并且這種高表達與卵巢癌的組織學亞型有關,這說明CCR9/CCL25可能與參與了卵巢癌的進展。進一步的體外細胞研究發現CCR9-CCL25相互作用在卵巢癌細胞的侵襲、遷移運動中發揮重要的促進作用 [22-23]。
4.5 CCR9和乳腺癌研究
在乳腺癌中,CCR9在腫瘤組織中的表達明顯高于癌旁正常組織,并且低分化腫瘤組織中的CCR9表達最為明顯。CCR9/CCL25為乳腺腫瘤細胞生長提供了優勢環境,并通過PI3K/Akt依賴的方式使腫瘤對順鉑(Cisplatin)產生耐藥性。在體外實驗中還發現CCR9的表達與腫瘤的侵襲性有關:高侵襲性乳腺癌細胞株CCR9高表達,低侵襲性乳腺癌細胞株CCR9顯著減低。Transwell實驗顯示,CCR9-CCL25促進乳腺癌細胞的侵襲和遷移。因此,CCR9/CCL25生物軸在乳腺癌發生、發展中發揮的作用與結腸癌及卵巢癌相似 [24-26]。
4.6 CCR9和胰腺癌研究
體外細胞實驗表明趨化因子受體CCR9及其配體CCL25結合,明顯促進腺上皮內瘤和胰腺癌細胞增殖。CCR9在胰腺癌組織中表達,胰腺癌細胞可分泌CCL25,CCL25分泌的增加可激活CCR9的表達,從而促進胰腺癌細胞的侵襲。CCR9和CCL25在胰腺癌引流淋巴結、胰腺癌組織和良性病變組織中的表達呈梯度分布,引流淋巴結中的表達量最高。胰腺癌中CCR9-CCL25與胰腺癌淋巴結轉移密切相關,且與胰腺癌腫瘤細胞分化程度和TNM分期相關。研究者認為CCR9可能成為胰腺癌綜合治療研究的新突破口 [27-28]。
4.7 CCR9和肺腺癌研究
肺腺癌中CCR9和ALDH1A1高表達,與遠轉移和不良預后密切相關。ALDH1A1高表達和遠處轉移是影響肺腺癌總生存期的獨立危險因素。進一步的研究發現,CCR9和ALDH1A1在肺腺癌中的表達存在正相關,ALDH high細胞中CCR9的表達明顯增高,CCR9/CCL25信號轉導通路能明顯促進肺腺癌腫瘤干細胞(Cancer stem cells,CSCs)的遷移和侵襲。通過該研究,揭示了肺腺癌遠處轉移和不良預后的新機制,也為CCR9/CCL25用作肺腺癌治療研究的新靶標提供了證據 [29-30]。
4.8 CCR9和非小細胞肺癌研究
對非小細胞肺癌(NSCLC,non-small cell lung cancer)組織和癌旁組織CCR9的表達進行檢測,發現CCR9高表達于NSCLC組織中,在對NSCLC細胞系NCI-H157細胞的檢測中得到同樣的結果,而CCR9在正常人支氣管上皮細胞BEAS-2B上未檢測到表達。體外實驗同樣證實,CCR9-CCL25對在NSCLC細胞侵襲和遷移能力上有重要作用。因此,目前的研究可以確定的是,CCR9/CCL25在NSCLC中高表達,與NSCLC淋巴結轉移等有關,但是其作用分子仍未見報道,還需要進一步研究 [31-34]。
4.9 CCR9和肝癌研究
采用免疫組化方法檢測出CCR9在肝細胞癌(hepatocellular carcinoma,HCC)組織樣本中顯著升高,并與HCC患者的預后相關,CCR9表達與HCC患者的OS成反比,可作為HCC患者OS獨立的預后因素,進一步研究發現CCR9的高表達預后差的原因主要是由于CCR9表達通過下調細胞周期調節因子p21,p27和上調細胞周期蛋白D1,從而增強了HCC的增殖和致瘤性的原因所導致的,因此CCR9可作為HCC的新型預后標志物。但目前CCR9/CCL25在肝癌領域的研究較少,仍需進一步系統性的研究 [35]。
4.10 CCR9和黑色素瘤研究
CCR9在黑色素瘤小腸轉移灶、黑色素瘤細胞和由轉移灶分離建立的細胞株中均高表達,研究者認為CCR9可能在黑色素瘤細胞小腸轉移過程中起到關鍵的作用。此外,轉移到腸道的黑色素瘤可檢測到CCR9的表達,轉移到其他器官的細胞則不表達CCR9,這說明高表達CCR9的黑色素瘤可特異性轉移至小腸。體外Transwell實驗證實CCR9/CCL25生物軸的作用下,黑色素瘤細胞侵襲和遷移能力明顯增強,而當CCR9/CCL25生物軸被anti-CCR9抗體或CCR9的RNA干擾技術破壞后,其促進黑色素瘤細胞侵襲和遷移能力的作用被顯著削減 [36-40]。
5. CCR9的臨床藥物研究前景
目前已有7種針對CCR9的藥物研究,包括SRB1、NR11/1943 (Norgine)、OB-003、CCX-025、MLN-3126、Vercirnon Sodium和CCX-5072。這些藥物通過拮抗CCR9的作用機制,阻斷其與CCL25配體的結合,從而抑制CCR9調控的T細胞遷移和活化。這些藥物研究適應癥范圍廣泛,覆蓋炎癥性腸病、腫瘤和其他消化系統、免疫系統、眼部、口頜等多種疾病。不同藥物的研發階段不一,部分已進入臨床試驗。這些藥物大多是小分子化合物,包括一種抗體,研究機構有Sunrock Biopharma SL、Norgine Ltd.、Orion Biotechnology Canada Ltd.等。近年來的研究揭示趨化因子家族在腫瘤發生發展中的重要作用,CCR9作為趨化因子受體成員之一,不僅可作為預測腫瘤預后的指標,而且靶向CCR9或者阻斷CCL25/CCR9軸的藥物對腫瘤的臨床研究提供了新的視角。當然,未來需要更多的研究為CCR9靶向研究提供藥理基礎。
為鼎力協助各藥企針對CCR9在炎癥性和多種腫瘤在臨床中的研究,華美CUSABIO推出CCR9活性蛋白(CSB-MP004845HU)和抗體(CSB-RA004845MA1HU)產品,助力您在CCR9機制方面的研究或其潛在臨床價值的探索。
華美 CUSABIO CCR9 蛋白
● Recombinant Human C-C chemokine receptor type 9 (CCR9)-VLPs (Active) Code: CSB-MP004848HU
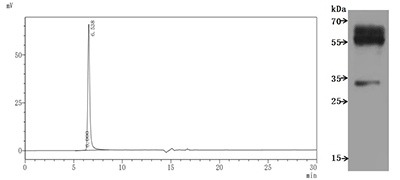
CSB-MP004848HU is detected by Mouse anti-6*His monoclonal antibody. The purity of VLPs was greater than 95% as determined by SEC-HPLC.
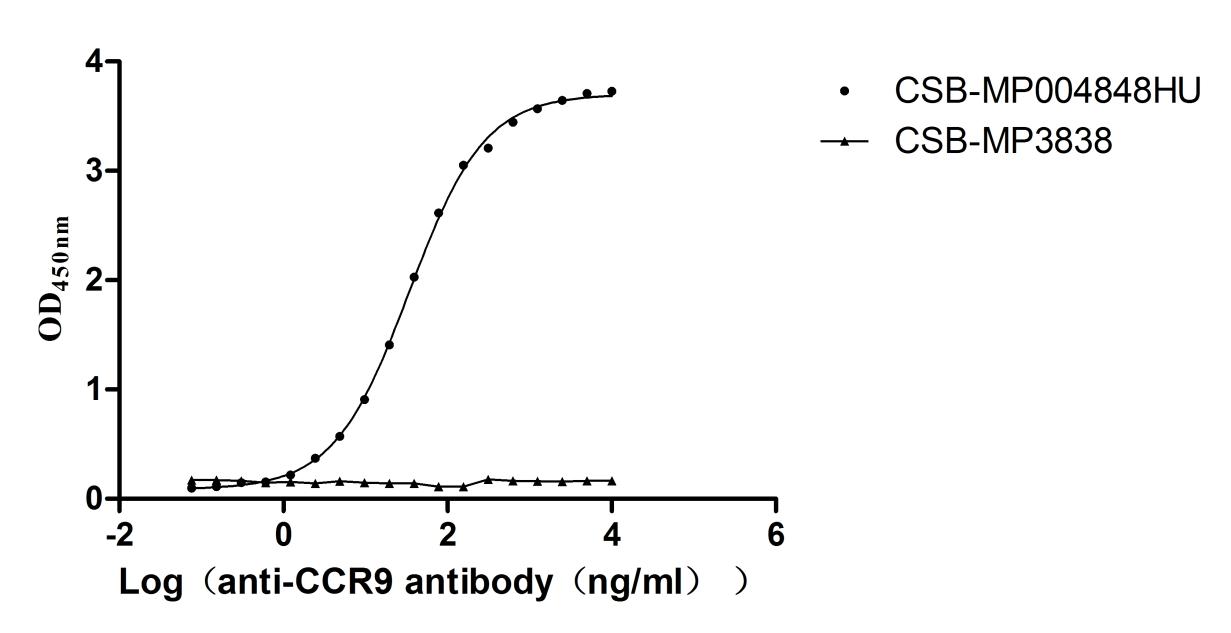
Immobilized Human CCR9 at 10μg/mL can bind Anti-CCR9 recombinant antibody (CSB-RA004848MA1HU). The EC50 is 31.67-36.83 ng/mL.The VLPs (The VLPs (CSB-MP3838) is negative control.
● Recombinant Human Atypical chemokine receptor 2 (ACKR2) (Active) Code: CSB-CF004618HU

(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
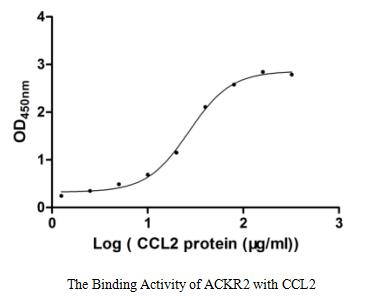
Immobilized ACKR2 at 1 μg/ml can bind human CCL2. The EC50 of human CCL2 protein is 23.52-30.99 μg/ml.
參考文獻:
[1] Tu, Zhenbo, et al. "CCR9 in cancer: oncogenic role and therapeutic targeting." Journal of hematology & oncology 9.1 (2016): 1-9.
[2] Huber, Max E., et al. "A chemical biology toolbox targeting the intracellular binding site of CCR9: fluorescent ligands, new drug leads and PROTACs." Angewandte Chemie International Edition 61.12 (2022): e202116782.
[3] Oswald, Christine, et al. "Intracellular allosteric antagonism of the CCR9 receptor." Nature 540.7633 (2016): 462-465.
[4] Letsch, Anne, et al. "Functional CCR9 expression is associated with small intestinal metastasis." Journal of Investigative Dermatology 122.3 (2004): 685-690.
[5] Uehara, Shoji, et al. "Characterization of CCR9 expression and CCL25/thymus-expressed chemokine responsiveness during T cell development: CD3highCD69+ thymocytes and γδTCR+ thymocytes preferentially respond to CCL25." The Journal of Immunology 168.1 (2002): 134-142.
[6] Xu, Baoping, et al. "CCR9 and CCL25: A review of their roles in tumor promotion." Journal of cellular physiology 235.12 (2020): 9121-9132.
[7] Wu, Xue, et al. "The roles of CCR9/CCL25 in inflammation and inflammation-associated diseases." Frontiers in cell and developmental biology 9 (2021): 686548.
[8] Mir, Hina, and Shailesh Singh. "CCL25 signaling in the tumor microenvironment." Tumor Microenvironment: The Role of Chemokines–Part B (2021): 99-111.
[9] Wang, Cong, et al. "The role of chemokine receptor 9/chemokine ligand 25 signaling: From immune cells to cancer cells." Oncology letters 16.2 (2018): 2071-2077.
[10] Li, Baijun, et al. "CCR9–CCL25 interaction suppresses apoptosis of lung cancer cells by activating the PI3K/Akt pathway." Medical Oncology 32 (2015): 1-9.
[11] Sharma, Praveen K., et al. "CCR9 mediates PI3K/AKT‐dependent antiapoptotic signals in prostate cancer cells and inhibition of CCR9‐CCL25 interaction enhances the cytotoxic effects of etoposide." International journal of cancer 127.9 (2010): 2020-2030.
[12] Chai, Songling, et al. "CCL25/CCR9 interaction promotes the malignant behavior of salivary adenoid cystic carcinoma via the PI3K/AKT signaling pathway." PeerJ 10 (2022): e13844.
[13] Johnson-Holiday, Crystal, et al. "CCR9-CCL25 interactions promote cisplatin resistance in breast cancer cell through Akt activation in a PI3K-dependent and FAK-independent fashion." World journal of surgical oncology 9.1 (2011): 1-7.
[14] Soldevila, Gloria, and Eduardo A. García‐Zepeda. "The role of the Jak‐Stat pathway in chemokine‐mediated signaling in T lymphocytes." Signal Transduction 7.5‐6 (2007): 427-438.
[15] Lu, Jianming, et al. "The selective CCR9 antagonist CCX8037 inhibits CCL25-CCR9-STAT3 mediated proliferation of pancreatic cancer cells." Cancer Research 70.8_Supplement (2010): 2531-2531.
[16] Santamaria, Silvia, et al. "Therapeutic potential of an anti-CCR9 mAb evidenced in xenografts of human CCR9+ tumors." Frontiers in Immunology 13 (2022): 825635.
[17] Qiuping, Zhang, et al. "Selectively increased expression and functions of chemokine receptor CCR9 on CD4+ T cells from patients with T-cell lineage acute lymphocytic leukemia." Cancer research 63.19 (2003): 6469-6477.
[18] Mirandola, Leonardo, et al. "Notch1 regulates chemotaxis and proliferation by controlling the CC‐chemokine receptors 5 and 9 in T cell acute lymphoblastic leukaemia." The Journal of pathology 226.5 (2012): 713-722.
[19] Amersi, Farin F., et al. "Activation of CCR9/CCL25 in cutaneous melanoma mediates preferential metastasis to the small intestine." Clinical cancer research 14.3 (2008): 638-645.
[20] Singh, Shailesh, et al. "Expression and functional role of CCR9 in prostate cancer cell migration and invasion." Clinical cancer research 10.24 (2004): 8743-8750.
[21] Sharma, Praveen K., et al. "CCR9 mediates PI3K/AKT‐dependent antiapoptotic signals in prostate cancer cells and inhibition of CCR9‐CCL25 interaction enhances the cytotoxic effects of etoposide." International journal of cancer 127.9 (2010): 2020-2030.
[22] Johnson, Erica L., et al. "CCL25-CCR9 interaction modulates ovarian cancer cell migration, metalloproteinase expression, and invasion." World journal of surgical oncology 8.1 (2010): 1-10.
[23] Singh, Rajesh, et al. "Expression and histopathological correlation of CCR9 and CCL25 in ovarian cancer." International journal of oncology 39.2 (2011): 373-381.
[24] Zhang, Ziqi, et al. "CCL25/CCR9 signal promotes migration and invasion in hepatocellular and breast cancer cell lines." DNA and cell biology 35.7 (2016): 348-357.
[25] Johnson-Holiday, Crystal, et al. "CCL25 mediates migration, invasion and matrix metalloproteinase expression by breast cancer cells in a CCR9-dependent fashion." International journal of oncology 38.5 (2011): 1279-1285.
[26] Johnson-Holiday, Crystal, et al. "CCR9-CCL25 interactions promote cisplatin resistance in breast cancer cell through Akt activation in a PI3K-dependent and FAK-independent fashion." World journal of surgical oncology 9.1 (2011): 1-7.
[27] Shen, Xiaoming, et al. "CC chemokine receptor 9 enhances proliferation in pancreatic intraepithelial neoplasia and pancreatic cancer cells." Journal of Gastrointestinal Surgery 13 (2009): 1955-1962.
[28] Heinrich, Eileen L., et al. "Paracrine activation of chemokine receptor CCR9 enhances the invasiveness of pancreatic cancer cells." Cancer Microenvironment 6 (2013): 241-245.
[29] Lu, Lin, et al. "CCR9 promotes migration and invasion of lung adenocarcinoma cancer stem cells." International journal of medical sciences 17.7 (2020): 912.
[30] Zhong, Yonglong, et al. "Expression of CC chemokine receptor 9 predicts poor prognosis in patients with lung adenocarcinoma." Diagnostic pathology 10.1 (2015): 1-7.
[31] Fan, Jian, et al. "Chemokine receptor 9 high-expression involved in the migration and invasion of the non-small-cell lung cancer cells."Asian Biomedicine 5.1 (2011): 69-76.
[32] Gupta, Pranav, et al. "CCR9/CCL25 expression in non-small cell lung cancer correlates with aggressive disease and mediates key steps of metastasis." Oncotarget 5.20 (2014): 10170.
[33] Li, Baijun, et al. "CCR9–CCL25 interaction suppresses apoptosis of lung cancer cells by activating the PI3K/Akt pathway." Medical Oncology 32 (2015): 1-9.
[34] Niu, Yuxu, et al. "CCL25 promotes the migration and invasion of non?small cell lung cancer cells by regulating VEGF and MMPs in a CCR9?dependent manner." Experimental and Therapeutic Medicine 19.6 (2020): 3571-3580.
[35] Zhang, Zhenhai, et al. "CCR9 as a prognostic marker and therapeutic target in hepatocellular carcinoma." Oncology Reports 31.4 (2014): 1629-1636.
[36] Amersi, Farin F., et al. "Activation of CCR9/CCL25 in cutaneous melanoma mediates preferential metastasis to the small intestine." Clinical cancer research 14.3 (2008): 638-645.
[37] Kühnelt-Leddihn, Laura, et al. "Overexpression of the chemokine receptors CXCR4, CCR7, CCR9, and CCR10 in human primary cutaneous melanoma: a potential prognostic value for CCR7 and CCR10?." Archives of dermatological research 304 (2012): 185-193.
[38] Richmond, Ann. "CCR9 homes metastatic melanoma cells to the small bowel." Clinical Cancer Research 14.3 (2008): 621-623.
[39] Hwang, Sam T. "Chemokine receptors in melanoma: CCR9 has a potential role in metastasis to the small bowel." J invest Dermatol 122.3 (2004): 14-15.
[40] Van Den Oord, Joost. "The CCR9–CCL25 axis mediates melanoma metastasis to the small intestine." Nature clinical practice Oncology 5.8 (2008): 440-441.










