細胞活力概述
日期:2023-12-06 16:02:00
細胞基礎實驗是用于研究許多生化或細胞功能的通用工具,包括細胞增殖、形態學、遷移、凋亡、遺傳學和信號轉導等。與體內研究相比,體外細胞基礎實驗更便宜,并且可以高通量進行。細胞基礎實驗通常用于細胞毒性測試,以評估藥物的功效,確定主要研究的作用機制(MOA),以及確定患者產生的抗體是否能中和藥物產品。細胞基礎實驗的前提是確保培養基中的細胞是活的。在進行細胞基礎實驗之前,應該評估細胞存活率。細胞存活的確定在所有形式的細胞培養中都起著重要作用[1]。
在本文中,我們將從六個方面介紹細胞存活率,包括定義、檢測意義、指標、檢測方法、不同檢測方法的比較,以及存活率、活力和增殖之間的區別。
1. 什么是細胞存活率?
細胞存活率是一個群體中存活細胞的比例測量。細胞存活率是一個以百分比表示的相對測量。它通常與細胞健康和細胞群體的生存和成功功能能力相一致。
2. 為什么要測量細胞存活率?
細胞存活率的測量旨在量化樣本中的整體健康細胞,并評估細胞對各種處理和刺激的反應。
例如,細胞存活率測定有助于篩選化學物質對各種細胞的細胞毒性,并在癌癥化療中選擇抗癌藥物及其劑量。
測量從組織中分離的細胞的存活率,以了解分離過程是否損傷了細胞。
在復蘇后,應該檢查細胞存活率,以了解冷凍和復蘇的影響。
有時,細胞存活率測定也用于優化細胞培養或環境條件。
或者,細胞變異性可以用于相關細胞行為以及細胞數量,從而提供對細胞代謝的詳細分析。
3. 什么是細胞存活率的指標?
細胞存活率反映了細胞群體的整體健康情況。因此,細胞膜滲透性、細胞代謝活性、ATP產生、酶活性和增殖能力可以指示細胞的存活率 [2]。
4. 細胞存活率檢測方法
細胞存活率可以通過許多方法進行評估,從最簡單且廣泛使用的染料排除法到對ATP含量和酶活性進行高度復雜的分析。選擇最佳的存活率測定方法應該詳細考慮細胞類型、應用的培養條件以及所需設備的成本、速度和復雜性。
4.1 染料排除法
染料排除法是用于細胞存活率鑒定的簡單且最常用的方法之一。染料排除法的原理是死細胞會吸收染料并變色,而活細胞會排除染料,因為它們具有完整的細胞膜。因此,可以使用血細胞計數器計算死細胞(著色)或存活細胞(無色)的數量。在多種使用的染料中,嘗試藍是其中最常用的。在嘗試藍染色中,死細胞被染成藍色,活細胞則不被染色[3]。然而,凋亡細胞在染料排除法中也被計算為存活細胞,因為它們的細胞膜仍然完整。因此,在可靠的細胞存活率和健康研究中,通常會通過流式細胞術測量凋亡細胞的水平以及存活細胞的數量。
4.2 細胞增殖測定
健康細胞會積極增殖,而受限、老化、死亡或垂死的細胞則不能。因此,細胞增殖測試是評估細胞存活率的有用工具。通過測量DNA合成和免疫染色細胞周期特異性蛋白質可以進行細胞增殖測定。許多生物公司開發了基于熒光微孔板的細胞增殖測定試劑盒,用于定量細胞并評估細胞增殖。最常用的增殖蛋白包括增殖細胞核抗原(PCNA)[4]、MKI67 [5]、磷酸組蛋白H3(H3-3A)[6]和MCM2 [7],可以通過WB、IF、IHC、流式細胞術和ELISA進行檢測。
4.3 比色法測定
代謝活性通常通過檢測細胞還原能力來評估。在活細胞中,NADPH將四唑鹽,包括MTT、MTS和XTT還原為紫色的嗎啉衍生物。MTT比色法是第一種用于適用于高通量篩選(HTS)的96孔板格式的均質細胞存活率測定方法 [8] [9]。在存活細胞中,黃色的MTT被還原為紫色的嗎啉。MTT測定中產生的嗎啉衍生物的數量通過在560 nm處通過分光光度法記錄吸光度讀數來測量,并且與存活細胞的數量直接成正比。MTS方法在原理上與MTT測定類似,但在靈敏度和操作上更高 [10]。
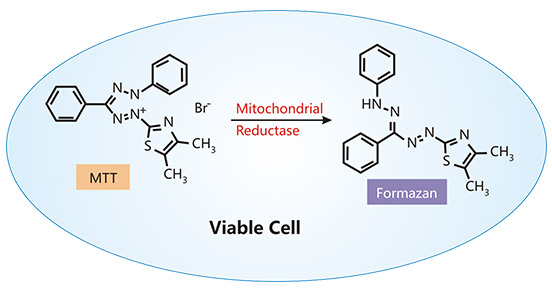
圖. MTT試驗
4.4 生物發光測定法
生物發光測定法可以快速、簡單地確定哺乳動物細胞的細胞增殖和細胞毒性。細胞增殖和細胞毒性可以間接反映細胞存活率。
● ATP測定
基于ATP的細胞存活率測定是一種敏感可靠的方法。只有存活細胞能夠合成ATP。內源性ATP是活細胞最基本的能源來源。當細胞死亡時,ATP會迅速水解。因此,內源性ATP含量的測定可以及時反映細胞的活性和存活率。
基于ATP的細胞存活率測定的反應原理是,在Mg2+和ATP的存在下,熒光酶催化熒光素氧化為氧化熒光素,產生與細胞內ATP濃度成比例的發光信號 [11-13]。因此,產生的信號強度間接地反映了存活細胞的相對數量 [14]。
● 實時存活率測定
實時存活率測定是一種新開發的生物發光測定法,可以在整個時間過程中監測細胞的生長。Duellman SJ及其同事在細胞培養基中添加了一種小分子前底物和一種源自海洋蝦的工程熒光酶作為試劑。需要注意的是,前底物不是熒光酶的底物。在活細胞中,前底物被還原為底物,熒光酶催化產生發光信號。該發光信號可以在長時間內從樣品孔中重復記錄,以實時測量細胞數量 [15]。
4.5 酶活性
與非存活細胞不同,存活細胞具有神秘的活性。酯酶活性,作為底物的衡量,例如不發光的細胞可滲透染料羧基氟熒光素二乙酸酯(CFDA),通常用作總體酶活性的指標。進入活細胞后,細胞內酯酶將CFDA水解為羧基氟熒光素,這是一種帶負電的熒光分子。羧基氟熒光素在活細胞中不共價地保留,并產生綠色熒光。發光強度與存活細胞的數量正相關。
5. 不同檢測方法的比較
上述細胞存活率測定法各有優劣。下表分別列出了它們的特點。
| 細胞活力測定 | 優點 | 缺點 |
|---|---|---|
| 染料排除試驗 | 簡單迅速的;低成本;需要少量的細胞;可以檢測非分裂細胞群中死亡的細胞。 | 有些染料對哺乳動物細胞有毒副作用;難以同時處理大量樣品;最終結果不是很準確(包括凋亡細胞的數量)。 |
| 細胞增殖抑制試驗 | 準確可靠 | 耗時 |
| 比色法 | 使用方便、安全、快速、可靠、靈敏、經濟、可重復性強。 | 許多因素,包括酶調節、pH、細胞離子濃度、孵育時間、細胞類型和數量都可能影響最終結果。 |
| Bioluminometric 化驗 | 速度快,靈敏,簡單。 | ATP測定的靈敏度通常受到移液重復樣品的可重復性的限制;最終代謝活性細胞對前底物的消耗限制了實時測定的結果。 |
| 酶活性 | CFDA對細胞無毒 | 受試化合物的熒光干擾可能影響最終結果 |
6. 細胞存活率、細胞活力和細胞增殖
細胞存活率、細胞活力和細胞增殖是細胞的三種不同生理狀態。它們都反映了細胞是活著的。然而,存活率是對細胞群體中存活細胞數量的量化,而細胞增殖是在一段時間內測量細胞數量的指標 [16]。細胞存活率測定方法,如染料排除法,只是區分活細胞和死細胞。細胞增殖的測量可以監測一段時間內細胞數量、細胞分裂次數、代謝活性或DNA合成。然而,并非所有存活細胞都會分裂。盡管細胞增殖可以輕松解釋為存活率,但非增殖不應自動被視為細胞死亡的標志。
除了細胞死亡,化學或物理因素的毒性效應可能導致細胞凋亡或壞死(細胞代謝和生理后果阻止細胞分裂),但細胞本身仍然可能存活 [17]。這種現象被稱為“細胞活力”,即細胞的生理能力。
目前,在毒理學和藥理學領域已經應用了各種細胞存活率測定方法。理想的體外存活率測定方法應該是快速、安全、可靠、高效、及時和經濟,并且不干擾測試化合物。測試化合物的作用模式、組織或細胞類型在研究中的使用也會影響細胞存活率測定方法的性能。因此,在選擇測試方法之前最好嘗試并比較不同的方法。如果可能,在體外研究中應該使用多種檢測方法來確定細胞存活率,從而獲得可靠和準確的結果。
參考文獻:
[1] Martin J Stoddart. Cell viability assays: introduction [J]. Methods Mol Biol. 2011;740:1-6.
[2] Ishiyama M, Tominaga H, et al. Combined assay of cell viability and in vitro cytotoxicity with a highly water-soluble tetrazolium salt, neutral red and crystal violet [J]. Biological & Pharmaceutical Bulletin. 1996;19(11):1518-1520.
[3] Strober W. Trypan blue exclusion test of cell viability [J]. Current Protocols in Immunology. 2001;21(3B):A.3B.1-A.3B.2.
[4] Wojciech Strzalka and Alicja Ziemienowicz. Proliferating cell nuclear antigen (PCNA): a key factor in DNA replication and cell cycle regulation [J]. Ann Bot. 2011 May; 107(7): 1127–1140.
[5] Scholzen T, Gerdes J. The Ki-67 protein: from the known and the unknown [J]. J Cell Physiol. 2000;182:311-22.
[6] Hu C, Wang W, et al. Vertebrate diapause preserves organisms long term through Polycomb complex members [J]. Science. 2020;367:870- 874.
[7] Coolen M, Labusch M, et al. Mosaic Heterochrony in Neural Progenitors Sustains Accelerated Brain Growth and Neurogenesis in the Juvenile Killifish N. furzeri [J]. Curr Biol. 2020;30:736-745.e4.
[8] Mosmann T. Rapid colorimetric assay for cellular growth and survival: Application to proliferation and cytotoxicity assays [J]. J. Immunol. Meth. 1983;65:55–63.
[9] László Kupcsik. Estimation of cell number based on metabolic activity: the MTT reduction assay [J]. Methods Mol Biol. 2011;740:13-9.
[10] Berridge M, Herst P, et al. Tetrazolium dyes as tools in cell biology: new insights into their cellular reduction [J]. Biotechnol Annu Rev. 2005;11:127-52.
[11] Mueller H, Kassack MU, et al. Comparison of the usefulness of the MTT, ATP and calcein assays to predict the potency of cytotoxic agents in various human cancer cell lines [J]. Journal of Biomolecular Screening. 2004;9:506-515.
[12] Lundin A, Hasenson M, et al. Estimation of biomass in growing cell lines by adenosine triphosphate assay [J]. Methods Enzymol. 1986;133:27-42.
[13] Crouch S, Kozlowski R, et al. The use of ATP bioluminescence as a measure of cell proliferation and cytotoxicity [J]. J Immunol Methods. 1993;160:81-8.
[14] Andreotti PE, Cree IA, et al. Chemosensitivity testing of human tumors using a microplate adenosine triphosphate luminescence assay: Clinical correlation for cisplatin resistance of ovarian cancer [J]. Cancer Research. 1995;55:5276-5282.
[15] Duellman SJ, Zhou W, et al. Bioluminescent, nonlytic, real-time cell viability assay and use in inhibitor screening [J]. Assay and Drug Development Technologies. 2015;13(8):456-465.
[16] N.Yang, S.D.Ray, et al. Cell Proliferation [J]. Encyclopedia of Toxicology (Third Edition) 2014, Pages 761-765.
[17] Magdalena Kwolek-Mirek and Renata Zadrag-Tecza. Comparison of methods used for assessing the viability and vitality of yeast cells [J]. FEMS Yeast Research, Volume 14, Issue 7, November 2014, Pages 1068–1079.
上一篇: 細胞分化決定細胞的命運
下一篇: 細胞衰老及其標志物










