淋巴細胞的表面標志物
日期:2023-11-28 09:24:15
淋巴細胞是最小的白細胞,是淋巴器官產生的一種免疫識別細胞系。根據它們的遷移、表面標志物和生物功能,淋巴細胞可以分為三類:T淋巴細胞(T細胞)、B淋巴細胞(B細胞)和自然殺傷細胞(NK細胞)。這三個亞群在免疫中發揮不同的作用:T淋巴細胞引發細胞介導的免疫,B淋巴細胞主要負責體液免疫,NK細胞介導先天免疫。
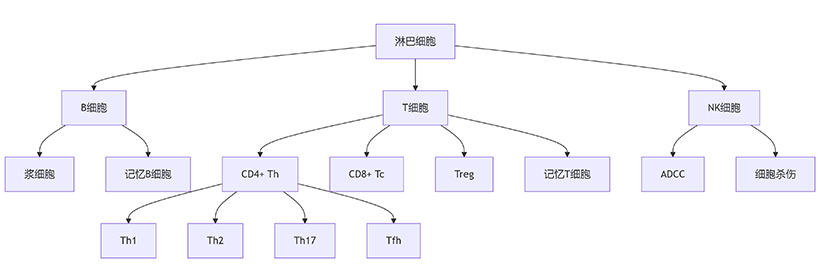
圖1. 淋巴細胞亞群
1. 為什么要鑒定不同的淋巴細胞亞群?
淋巴細胞亞群的平衡維持著機體正常的免疫功能。淋巴細胞亞群數量和功能的異常變化會導致一系列病理變化和免疫功能紊亂,從而導致疾病的發生。研究表明,淋巴細胞亞群在腫瘤形成 [1] [2]、傳染病 [3] [4]、器官移植 [5] [6]、自身免疫性疾病、糖尿病等過程中起著重要作用。因此,臨床上淋巴細胞亞群的鑒定和監測具有重要意義。
2. 如何鑒定不同的淋巴細胞亞群?
三種類型的淋巴細胞在形態上基本相似,需要通過表面標志物檢測來區分不同的亞群。淋巴細胞表面標志物根據淋巴細胞類型和分化階段而異。
3. 什么是細胞表面標志物?
細胞表面標志物是嵌入在細胞膜脂雙層結構中的膜蛋白,通常包括膜抗原、膜受體和其他分子。淋巴細胞與周圍環境中的其他細胞和分子之間的相互作用,以及在抗原中淋巴細胞的生物效應,包括識別、激活、輔助、抑制和殺傷,都與它們的表面標志物有關。利用細胞表面標志物來區分T淋巴細胞和B淋巴細胞極大地推動了免疫現象的細胞基礎分析 [7]。
淋巴細胞表面標志物的檢測在基礎和臨床免疫學研究以及患者免疫功能測定中得到廣泛應用。淋巴細胞表面標志物通常分為三大類:表面免疫球蛋白(SIg)、分化抗原(或特異性抗原)和膜受體。CD(分化簇)分子是最常用的細胞表面標志物之一。
4. T淋巴細胞及其細胞表面標志物
4.1 T淋巴細胞
T細胞是特異性抗原的淋巴細胞,源自造血組織并在胸腺中成熟。它們得名于此——胸腺依賴性淋巴細胞。T細胞可以分為輔助T細胞(Th)、細胞毒性T細胞(Tc)和調節性T細胞(Treg)。Th/Tc比例的改變會改變機體的免疫功能 [8]。當受到抗原刺激時,T淋巴細胞會轉化為淋巴母細胞,然后分化為致敏的T淋巴細胞,參與細胞免疫。它主要抵御細胞內感染、腫瘤細胞和同種異體細胞。
NKT淋巴細胞是具有NK細胞特性的T淋巴細胞亞群 [9],它們既具有T淋巴細胞的抗腫瘤免疫活性,又具有NK細胞的非MHC限制性抗腫瘤特性 [10]。它們在抗感染、抗腫瘤、自身免疫平衡調節等方面起著重要作用[11]。
4.2 T淋巴細胞細胞表面標志物
在T淋巴細胞中,輔助T細胞可以進一步分為Th0、Th1、Th2、Th3(TGF-β)、Th17(IL17)等。
通過相對特異的CD抗原標記可以區分Th1和Th2:
Th1---CD3 +CD4+CD30-
Th2---CD3+CD4+CD30+
研究表明,Th1具有明顯的細胞毒性效應,主要分泌細胞因子如IL2、IFN-γ或TNF-β,以協助細胞免疫或參與遲發型超敏反應。Th1細胞表面標志物還包括IL-12β2R [12] 和IL-18R [13]。Th2沒有細胞毒性效應,主要分泌細胞因子如IL4、IL5、IL6或IL10,以協助體液免疫,并參與快速型超敏反應。
研究發現 [14],Th1/Th2不平衡紊亂與多種疾病過程有關,如腫瘤免疫、移植免疫和過敏。
在T淋巴細胞中,細胞毒性T細胞(Tc)還可以進一步分為:
Tc1(IFN-γ)和Tc2(IL-4、IL5、IL-10)。
區分Tc1和Tc2的相對特異的CD抗原標記:
Tc1---CD3+CD8+CD30-
Tc2---CD3+CD8+CD30+
以下表格是T淋巴細胞的細胞表面標志物。
表1. 主要CD抗原及其在T細胞表面的分布
| CD抗原 | 分布 |
|---|---|
| CD2(ER) | 所有的T細胞和NK細胞 |
| CD3 | 成熟T細胞 |
| CD4(HIVR) | Th 細胞 |
| CD8 | Tc細胞,部分NK細胞 |
| CD25(IL-2R) | 活化T細胞 |
| CD28 | T 細胞 |
| CTLA-4 | 活化T細胞 |
| CD40L | 活化T細胞 |
4.2.1 CD2
CD2,又稱為LFA2,是一種黏附分子,能與綿羊紅細胞(SRBC)結合,也被稱為綿羊紅細胞受體(E受體)。它的配體是LAF3。它增強了T細胞與APCs或靶細胞之間的黏附,并促進T細胞對抗原的識別。其細胞質域可以與多種酪氨酸激酶結合,介導信號傳導。
4.2.2 CD3
CD3與TCR跨膜區結合形成穩定的TCR-CD3復合物。在這個復合物中,TCR負責識別抗原肽-MHC分子復合物,而CD3分子負責將激活信號傳導到細胞內。
CD3分子的細胞質域含有與免疫細胞激活信號轉導有關的免疫受體酪氨酸激活基序(ITAM),表明它參與免疫細胞的激活。
4.2.3 CD4
CD4是T輔助細胞的標記,是一種單鏈跨膜蛋白。其細胞外結構屬于IgSF,有四個IgSF結構域。第一和第二結構域可以與MHCII類分子結合。CD4作為TCR-CD3復合物識別抗原的輔助受體,通過與MHCII分子、p56lek激酶結合,參與信號傳導。
4.2.4 CD8
CD8是細胞毒性T細胞的標記,是由α鏈和β鏈通過二硫鍵連接形成的異二聚體,其細胞外結構是IgSF成員。CD8分子的細胞質區域可以與p56lek激酶結合,參與信號傳導。CD8+T淋巴細胞能夠特異性地殺傷靶細胞,具有抗腫瘤、抗病毒和重要的免疫調節作用,其主要功能是抑制免疫應答 [15]。
CD4和CD8分子將T細胞分為兩個明顯的亞群。CD4和CD8分別是MHCII類或MHCI類分子的受體,CD4+和CD8+細胞數量和比例的變化反映了機體的免疫功能狀態。
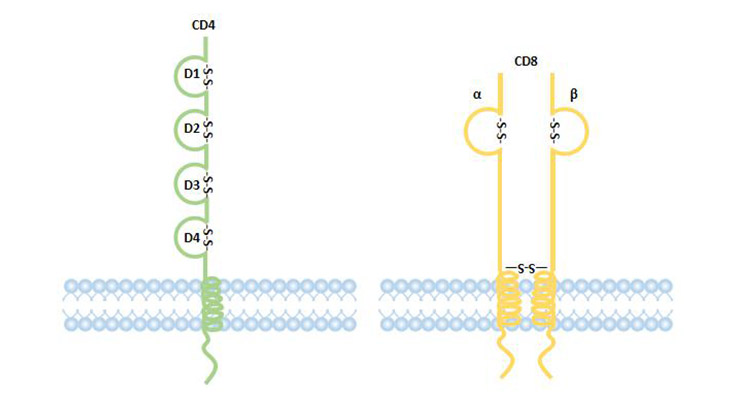
圖2. CD4和CD8編譯器的結構
4.2.5 CD28 和 CTLA-4(CD152)
它們是經典的共刺激分子。在結構上,兩者高度同源,由兩個多肽鏈連接形成同源二聚體。
CD28:在幾乎所有CD4+ T細胞中表達,50%的CD8+ T細胞中表達。漿細胞和部分活化的B細胞也表達CD28。
CTLA-4:僅在活化的T細胞上表達。
CD28和CTLA-4的天然配體是B7(CD80/CD86)。
CD28-B7(CD80/CD86)提供了T細胞激活的第二信號(共刺激信號)。
CTLA-4-B7(CD80/CD86)提供了激活的T細胞抑制信號。
4.2.6 CD40L(CD154)
它屬于Ⅱ型跨膜蛋白,主要在CD4+ T細胞和CD8+ T細胞表面的激活中表達。CD40L與B細胞表面的CD40相互作用,提供協同刺激信號,促進B細胞增殖、分化、抗體合成和依賴于胸腺抗原(TD-Ag)的免疫應答。
4.2.7 病毒受體
通過這些受體,病毒可以選擇性地感染T細胞的一個子群。例如,HIV可以通過感染輔助T細胞(CD4+細胞)來引發艾滋病。
4.2.8 其他表面標志物
包括白細胞介素受體、整合素受體、轉鐵蛋白受體等。
5. B淋巴細胞及其細胞表面標志物
5.1 B淋巴細胞
B細胞是來源于造血組織的特異性抗原淋巴細胞。與T細胞不同,B細胞在骨髓中分化和成熟。受抗原刺激后,B淋巴細胞首先轉化為漿母細胞,然后分化為漿細胞,產生和分泌免疫球蛋白(抗體),參與體液免疫。其功能包括產生抗體、呈遞抗原,以及分泌參與免疫調節的細胞因子 [16]。B細胞及其亞群的檢測是研究自身免疫疾病和疾病中的免疫調節紊亂的重要指標。
5.2 B細胞表面標志物
5.2.1 B細胞抗原受體,BCR / 表面膜免疫球蛋白,SmIg
它是嵌入在細胞膜脂質分子中的免疫球蛋白,在成熟的B細胞和大多數B細胞腫瘤細胞中表達。成熟的B細胞主要表達mIgM和mIgD,其含量也反映了細胞成熟的程度:IgM > IgD較為不成熟,IgD > IgM較為成熟。
BCR是B細胞最具特征性的表面標志物。它可以特異性地結合相應的抗原,也可以特異性地結合抗免疫球蛋白抗體。
5.2.2 補體受體(CR)
成熟的B細胞表面表達補體受體,主要是C3受體。
補體受體1(CR1),也稱為C3b受體或C3b / C4b受體,與C3b和C4b結合,促進B細胞激活。
補體受體2(CD21),B細胞的一個重要標記,也稱為C3d受體,同時也是Epstein-Barr病毒的受體。
5.2.3 分化抗原
CD19,CD20,CD21和CD40通常用于B細胞功能分析。
此外,還包括有絲分裂原受體、Fc受體、MHC抗原等表面標志物。
6. 自然殺傷細胞及其細胞表面標志物
6.1 自然殺傷細胞
自然殺傷細胞是胞漿中含有大顆粒的細胞。NK細胞的確切來源尚不明確,一般認為直接來源于骨髓。激活的NK細胞通過分泌細胞因子和細胞毒性 [19]發揮抗病毒 [17]、抗腫瘤 [18]和免疫調節作用。
6.2 NK細胞表面標志物
目前,CD3-CD16+CD56+通常被用作其典型標志。
CD16(FcγRIII),CD56(NCAM-1),CD94,CD158(KIR)和CD161(NKR-P1A)通常用于NK細胞功能分析。
綜上所述,淋巴細胞亞群可以通過細胞表面標志物進行區分,見表2。
表2. T、B、NK細胞表面標志物物比較
| 表面標志物 | T 細胞 | B 細胞 | NK 細胞 |
|---|---|---|---|
| 膜表面免疫球蛋白(SmIg) | - | + | - |
| TCR | + | - | - |
| CD2 | + | - | + |
| CD3 | + | - | - |
| CD19, CD20 | - | + | - |
| CD16, CD56 | - | - | + |
| 補體受體 (CR) | - | + | part |
| Fc 受體 | - | + | + |
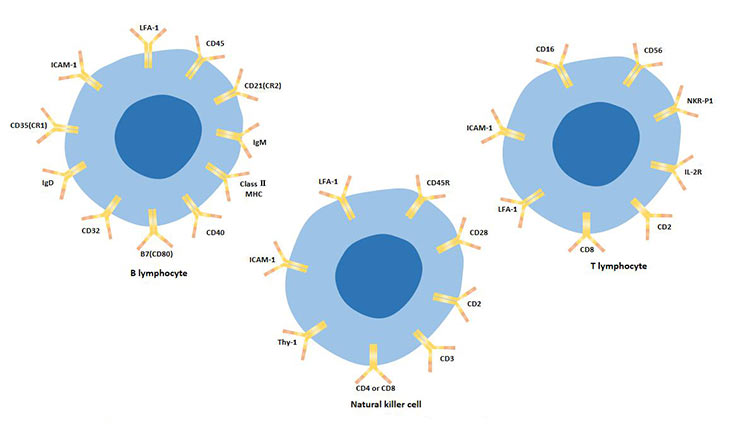
圖3. T淋巴細胞、B淋巴細胞和自然殺傷細胞的細胞表面標志物
7. 淋巴細胞的檢測
7.1 免疫熒光法
免疫熒光法包括間接免疫熒光法和直接免疫熒光法。
間接免疫熒光法的過程:首先,待檢測的細胞經過無標記抗體處理,與特定抗原形成復合物,然后使用熒光標記的抗抗體來檢測細胞中特定抗原的存在,從而產生熒光增強效應。
B細胞表面標志物-SmIg可以通過間接免疫熒光法進行檢測。
這種方法的特點具有很強的特異性,可以通過顯微鏡觀察準確地確定組織或細胞中熒光的分布情況。
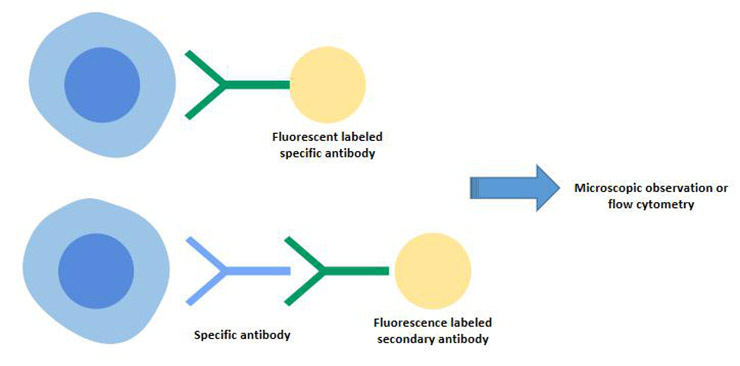
圖4. 間接免疫熒光和直接免疫熒光技術
7.2 免疫細胞化學
該方法通常采用酶聯免疫測定,如生物素-鏈霉素系統。通過顯微鏡,表現為棕黃色的細胞被判定為CD抗原陽性細胞。
7.3 紅細胞花環試驗
將用相應抗體標記的紅細胞作為指示物,與待檢測的細胞混合。
羊紅細胞(SRBC)與人類淋巴細胞(E花環)自發形成花環 [20] [21]。因此,可以用于檢測T細胞上的SRBC受體。這種方法的原理是利用T細胞表面的SRBC受體與SRBC形成花環。
該方法簡單,試劑相對便宜。這是一種經典的T淋巴細胞檢測方法。但其缺點是結果不太穩定,受個人主觀影響。
8. 淋巴細胞表面標志物的應用
淋巴細胞亞群的分析可以揭示患者免疫功能的平衡情況。
8.1 在腫瘤疾病中的應用
機體的免疫功能與惡性腫瘤的發生和發展密切相關。
腫瘤患者外周血的T淋巴細胞亞群異常。患者的CD3+細胞和CD4+細胞顯著減少,而CD8+細胞顯著增加。這種免疫抑制狀態降低了患者識別和殺傷突變細胞的能力。
8.2 在自身免疫性疾病中的應用
自身免疫性疾病患者的淋巴細胞亞群通常受到干擾。淋巴細胞比例的變化與自身免疫性疾病的發生和發展密切相關 [22]。
CD4+/CD8+比率的增加會導致自身免疫疾病 [23]。
淋巴細胞表面標志物還可以用于研究淋巴細胞分化的過程和功能。不同淋巴細胞群體的數量和功能的變化也可能與各種疾病的發生有關。例如,艾滋病患者的CD4+T細胞顯著減少甚至缺失。
因此,檢測淋巴細胞亞群在控制某些疾病的發生和發展、了解發病機制以及指導臨床治療方面具有重要意義。
參考文獻:
[1] Niu J, Chang Y, Lu X, et al. Effect of dendritic cell vaccine therapy on lymphocyte subpopulation in refractory primary brain tumor [J]. Indian J Cancer, 2016, 52(4): 587 -589.
[2] Hsieh CT, Luo YH, Chien CS, et al. Induced pluripotent stem cellconditioned medium suppressed melanoma tumorigenicity through the enhancement of Natural-Killer cellular immunity [J]. J Immunother, 2016, 39(4): 153-159.
[3] Lisse I M, Qureshi K, Poulsen A, et al. T-lymphocyte subsets and eosinophil counts in acute and convalescence chickenpox infection: a household study in Guinea- Bissau [J]. Journal of Infection, 2005, 50(2): 125-129.
[4] Yushchuk N D, Gadzhikulieva M M, Balmasova I P, et al. The role of immune factors in the progression of chronic kidney diseases in HIV infection [J]. Ter Arkh, 2015, 88(3): 56-61.
[5] Bravo Soto JA, Esteban De La Rosa RJ, Luna Del Castillo JD, et al. Effect of mycophenolate mofetil regimen on peripheral blood lymphocyte subsets in kidney transplant recipients [J]. Transplant Proc, 2003, 35(4): 1355-1359.
[6] Cho JH, Yoon YD, Jang HM, et al. Immunologic monitoring of T-Lymphocyte subsets and Hla-Dr-Positive monocytes in kidney transplant recipients: a prospective, observational cohort study [J]. Medicine (Baltimore), 2015, 94(44): e1902.
[7] Papamichail M. T and B Lymphocytes: Origins, Properties and Roles in Immune Responses [J]. Immunology, 1975, 28(1).
[8] Yasutomo K. The cellular and molecular mechanism of CD4/CD8 lineage commitment [J]. Journal of Medical Investigation Jmi, 2002, 49(1-2): 1.
[9] Godfrey D I, Macdonald H R, Kronenberg M, et al. NKT cells: what's in a name? [J]. Nature Reviews Immunology, 2004, 4(3): 231-237.
[10] Yamaguchi Y, Ohshita A, Kawabuchi Y, et al. Adoptive immunotherapy of cancer using activated Autologous lymphocytes-current status and new strategies [J]. Human Cell, 2010, 16(4): 183-189.
[11] Brigl M, Brenner M B. CD1: Antigen Presentation and T Cell Function [J]. Annual Review of Immunology, 2004, 22(1): 817-890.
[12] Rogge L, Barberis - Manino L, Biffi M, et al. Selective expression of an IL - 12 receptor component by human T helper 1 cells [J]. J Exp Med, 1997 , 185: 825-831.
[13] Xu D,Chan WL,Leung BP, et al. Selective expression and functions of IL - 18 recptor on T helper (Th) type 1 but not Th2 cells [J ]. J Exp Med,1998 ,188 (8): 1485-1492.
[14] Mosmann TR, Cherwinski H, BondMW, et al. Two types of murine helper T cell clone. I. Defination according to profiles of lymphokine activities and secreated proteins [J]. J Immunol, 1986 , 136: 2348-2357.
[15] Appay V, Lier R A W V, Sallusto F, et al. Phenotype and function of human T lymphocyte subsets: Consensus and issues [J]. Cytometry, 2008, 73A(11): 975-983.
[16] Yu Q M, Yu C D, Ling Z Q. Elevated Circulating CD19(+) Lymphocytes Predict Survival Advantage in Patients with Gastric Cancer [J]. Asian Pacific journal of cancer prevention, 2012, 13(5): 2219-2224.
[17] Aura M, Marcel C G, Andrea V, et al. Priming of NK Cell Anti-Viral Effector Mechanisms by Direct Recognition of Human Cytomegalovirus [J]. Frontiers in Immunology, 2013, 0-4.
[18] Krzywinska E, Allende-Vega N, Cornillon A, et al. Identification of Anti-tumor Cells Carrying Natural Killer (NK) Cell Antigens in Patients With Hematological Cancers [J]. EBioMedicine, 2015, 2(10): 1364-1376.
[19] Galazka G, Jurewicz A, Domowicz M, et al. HINT1 peptide/Hsp70 complex induces NK-cell-dependent immunoregulation in a model of autoimmune demyelination [J]. Eur J Immunol, 2014, 44(10): 3026-3044.
[20] Lay W H, Mendes N F, Bianco C, et al. Binding of sheep red blood cells to a large population of human lymphocytes [J]. Nature, 1971, 230(5295): 531-2.
[21] Brain P, Gordon J. Rosette formation by peripheral lymphocytes. II. Inhibition of the phenomenon [J]. Clinical & Experimental Immunology, 1971, 8(3): 441-9.
[22] Gopalakrishnan S, Sen S, Adhikari J S, et al. The role of T-lymphocyte subsets and interleukin-5 blood levels among Indian subjects with autoimmune thyroid disease [J]. Hormones (Athens, Greece), 2010, 9(1): 76-81.
[23] Harrington L E, Hatton R D, Mangan P R, et al. Interleukin 17–producing CD4+ effector T cells develop via a lineage distinct from the T helper type 1 and 2 lineages [J]. Nature Immunology, 2005, 6(11): 1123-1132.










