戰疫時刻|產品升級!新冠病毒S納米抗體助力科研
日期:2020-05-29 14:38:51
新型冠狀病毒(SARS-CoV-2)疫情的爆發引起全球范圍內廣泛關注。截至2020年5月29日,新型冠狀病毒已經感染超過590萬人,并奪走了超過36萬人的生命。
面對持續爆發的疫情,科學界亟需開發安全有效的抗病毒抗體,為抗擊新冠病毒提供新型藥物和治療方案。
單克隆抗體(mAb,簡稱單抗)是醫藥行業中規模最大、增長最快的領域。在之前的SARS和MERS疫情期間,一些中和單克隆抗體被開發出來,并證實了它們在治療冠狀病毒感染方面的潛力。然而它們的臨床使用還是受阻于真核系統的費時費力和昂貴的抗體生產過程以及其分子量大難以運送到特定組織發揮作用的難點。
而針對mAb的一個有吸引力的替代方案是利用駱駝免疫球蛋白制成的單域抗體(Single-domain antibody),也稱為VHH或納米抗體,它們是分子量為12-15 kDa的最小天然抗原結合蛋白結構域。與傳統的mAb(分子量為150 kDa)相比,它們的小尺寸提供了一些優勢,包括生產成本相對較低,以及在原核生物表達系統中易于在公斤級規模下快速生產。更重要的是,由于納米抗體的尺寸小、生物物理學特性好,可以通過吸入給藥的方式給藥,這使得它們特別適用于治療呼吸系統疾病。
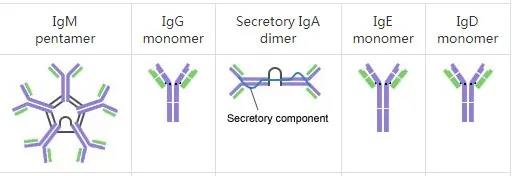
抗體,是成熟的B淋巴細胞分泌的一種蛋白分子,也就是人們常說的免疫球蛋白,呈現“Y”型。人體中共有五種抗體,分別是IgG、IgA、IgE、IgD和IgM。
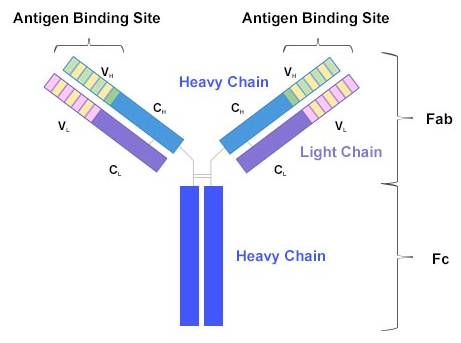
以我們血液中最多的抗體IgG為例,IgG有四條鏈,兩條輕鏈,兩條重鏈,它們通過二硫鍵結合在一起。輕鏈有輕鏈恒定區(CL)和輕鏈可變區(VL)。相應地,重鏈也有重鏈恒定區(CH)和重鏈可變區(VH)。與輕鏈不同的是,重鏈因為“更長”所以也更“重”,分子量更大。一條重鏈有三個恒定區,分別是CH1~CH3。
分子量小的抗體可以更方便地運送到病灶,但人血液里抗體IgG比較大,運送比較困難。那么有沒有更小的抗體呢?
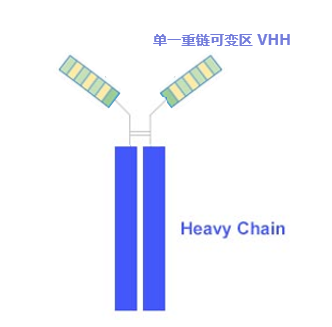
納米抗體(Nanobodies, Nbs)是由比利時科學家Hamers-Casterman及其團隊于1993年在自然雜志中首次報道發現,在駱駝科動物(駱駝,大羊駝,羊駝及其近親物種)血液中發現有一部分抗體是缺失輕鏈的“重鏈抗體”,該抗體只包含一個重鏈可變區(VHH)和兩條重鏈CH2與CH3區(如圖)。這種缺失輕鏈的重鏈抗體也能和正常的IgG等抗體一樣,去結合抗原。
而單獨把這個單一重鏈可變區(VHH)拿出來其本身也非常穩定,而且能和抗原結合。這就是目前最小的能夠結合目的抗原的單位,被稱為單域抗體(Single-domain antibodies),VHH晶體為2.5nm,長4nm,分子量只有15 kDa,因此被稱作納米抗體。
與傳統抗體相比,納米抗體具有相對分子質量小、人源化簡單、親和力高、穩定性高、可微生物表達、免疫原性低、可溶性好、滲透力強、可識別隱藏表位等優勢。結合了單克隆抗體的理想特性和小分子藥物的一些有益特性。
a.相對分子質量小:
傳統IgG抗體的大小為150 kDa,納米抗體為12-15 kDa,是傳統抗體的十分之一。
b.人源化簡單:
VH和VHH的序列同源性較高,可以看出駱駝體內抗體人源化的FR2區的四個氨基酸突變,對VHH區進行適當的改造即可得到人源化的納米抗體。
c.親和力高:
由重鏈抗體VH和單域抗體VHH的結構可知,VHH的高變區CDR3更長一些,這在與抗原發生特異性結合時更容易且緊密和穩定。
d.穩定性高:
Nbs內部有二硫鍵的存在,具有最佳的生物物理和生化特性,包括溶解度、耐熱性和蛋白水解抗性。
e.可微生物表達:
Nbs是解決單抗生產成本問題的一個很好的選擇。由于完全恢復了免疫特異性,Nbs可以在微生物系統(如細菌、酵母菌、真菌)中很容易表達,并且可以從展示文庫中快速選擇。
f.免疫原性低:
VHH和VH-VL在結構上相似,但是納米抗體分子量小,其表面的結合部位抗原決定簇少,所以相對于分子量大的抗體來說,納米抗體的免疫原性相對較低。
g.可溶性好、滲透力強:
深層快速的組織滲透,快速的血液清除。因為納米抗體(VHH)的框架(FR)區和互補決定(CDR)區域的表征顯示FR2區域的疏水性殘基突變為親水性殘基(親水氨基酸:Phe42, Glu49, Arg50, Gly52),傳統人類VH (疏水氨基酸:Val42, Gly49,Leu50 Trp52),所以納米抗體擁有更好的可溶性。此外,納米抗體(VHH)具有極強的組織滲透力,能夠進入致密的組織(如實體瘤)發揮其作用,甚至還可以有效地穿透血腦屏障。
f.識別隱藏的表位:
傳統Abs的結晶學研究表明,在大多數情況下,抗原結合面是平的或凹的。相反,Nbs常與裂隙和空腔結合。Nbs的這一特性及其較小的尺寸促進了與傳統VH-VL對所不能達到的新表位的相互作用,這也解釋了Nbs結合中和傳統抗體難以命中的靶點的能力。
2020年5月5日,生命科學領域國際著名雜志Cell在線刊發了美國得克薩斯大學奧斯汀分校Jason S. McLellan、比利時根特大學Xavier Saelens、Bert Schepens等研究人員的研究成果“Structural Basis for Potent Neutralization of Betacoronaviruses by Single-Domain Camelid Antibodies”。該研究發現羊駝體內的抗體有消滅新冠病毒的潛力。注射相應抗原后,羊駝體內產生了兩種分別用來對抗MERS和SARS的有效抗體,其中針對SARS的抗體偶聯成為雙價抗體后具有中和新冠病毒的潛力。不過,目前只是假病毒實驗的結果,尚不清楚這種偶聯后的抗體是不是在動物中也有保護作用,這都需要后續實驗來證實。
這一發現從結構上解析了從羊駝中分離出的單域抗體中和致病性冠狀病毒的有效機制,為冠狀病毒的治療提供了潛在的治療手段。
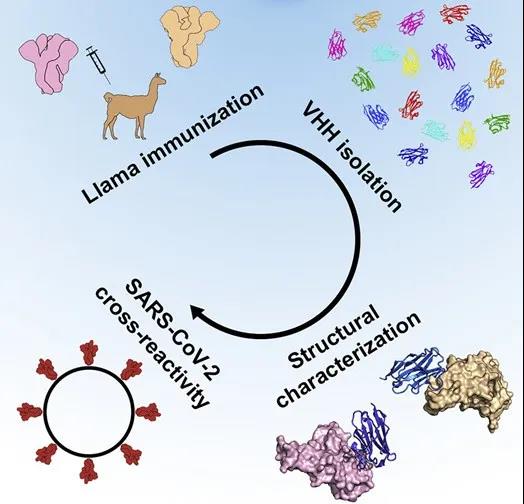
(信息來源:DOI:10.1016/j.cell.2020.04.031)
2020年5月14日,來自中國復旦大學的研究人員在線發表在Cell Host & Microbe期刊上,發表題為“Identification of Human Single-Domain Antibodies against SARS-CoV-2”的論文。科研人員成功地建立一種高效的方法來快速開發SARS-CoV-2特異性的全人源單域抗體,不僅可能在當前的疫情爆發時應對COVID-19,而且還可能加強對未來新型冠狀病毒的防范和應對能力。
該研究開發了一個用于快速分離人源納米抗體的通用平臺,并實現了SARS-CoV-2抗體的篩選。納米抗體不僅可單獨使用還能與其他抗體協同作用;小尺寸特征也成為了雙特異性或多特異性抗體理想的構建模塊,有效阻止病毒逃逸突變的出現等眾多優點。因此,這些全人源納米抗體有望開發成有效的防治藥物,應用于新冠肺炎的臨床救治。
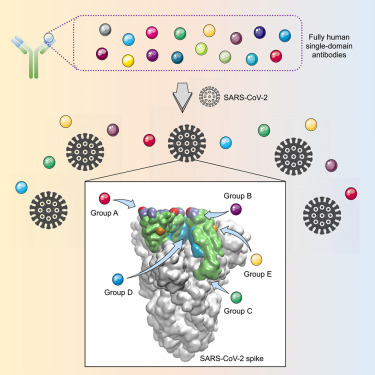
(信息來源:DOI:10.1016/j.chom.2020.04.023)
納米抗體(VHH)保留了全部的抗原結合能力,被認為是最小的保留完整抗原結合片段,其獨特的物理和化學穩定性等為診斷和治療提供了新的研究工具。在抗體藥物研發、醫學基礎研究以及疾病診斷和治療方面備受大家的關注。
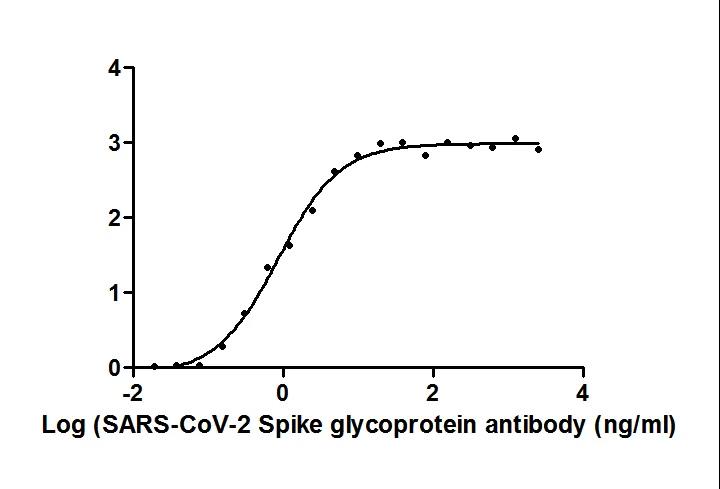
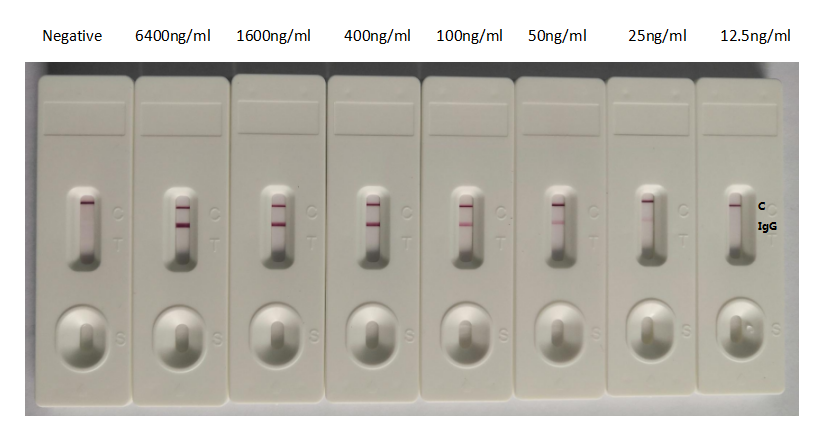
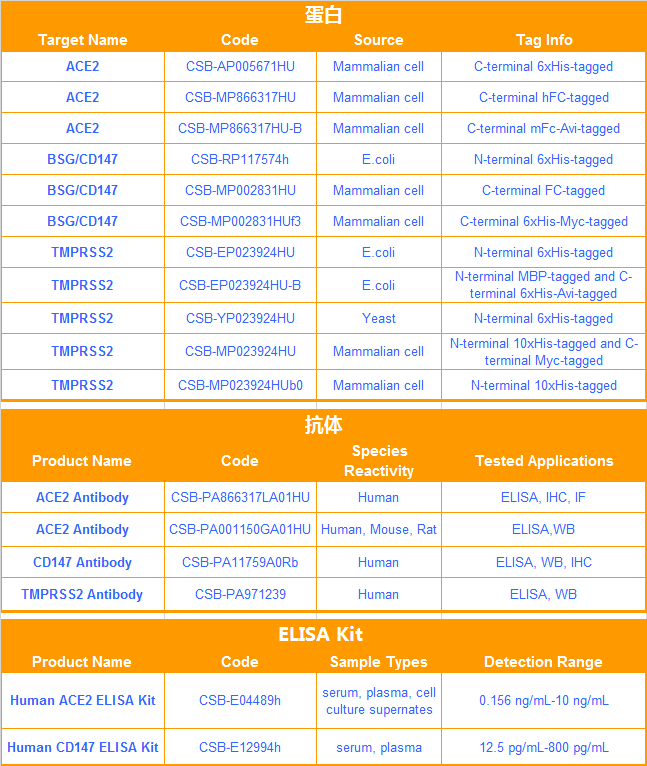
S 納米抗體產品(活性驗證)
種屬:Human Novel Coronavirus (SARS-CoV-2/ 2019-nCoV)
抗體亞型:VHH fusion with human IgG1 Fc
應用范圍:ELISA, GICA
—END—
——華美生物·讓科研變得有溫度!——

上一篇: 戰疫時刻|TMPRSS2——新冠病毒入侵的“潤滑油”
下一篇: 新品上線|新冠非結構蛋白三品連發!










