EphA3--細胞粘附和遷移的調節器
日期:2019-09-16 16:18:52
受體酪氨酸激酶(RTKs)是一類I型跨膜糖蛋白,它具有調節細胞生長、分化和遷移的功能。Eph受體家族(erythropoietin- producing human hepatocellular carcinoma)是目前為止最大的RTKs家族,該蛋白在結構上高度保守,成員眾多[1]。EphA3(以前稱為HEK)是Eph受體家族的一員,它的異常改變與多種腫瘤的發生、發展密切相關[2][3],可能會造成細胞形態特征和生物學特性的變化,如細胞的生長和存活率、細胞黏附、細胞遷移及抗凋亡能力的改變。
1. Eph受體的發現
1987年,Hirai等克隆得到了Eph基因家族的第一個成員EphA1[4],目前為止,在人類中,Eph基因家族已發現有14個成員[5],在正常組織及腫瘤細胞中均有廣泛地分布。EphA3受體最初是從前B淋巴白血病細胞表面(ALL)細胞系(LK63)中分離得到的表面抗原[6]。
2. Eph受體
根據Eph受體家族的同源性、表達、分布及與配體的結合特性的不同而將其分成A和B兩個亞類:即EphA (EphA1、EphA2、EphA3、EphA4、EphA5、EphA6、EphA7、EphA8、EphA10)、EphB (EphB1、EphB2、EphB3、EphB4、EphB6)受體。
2.1 Eph受體結構
EphA3基因位于3號染色體3p11.2區域,該區域在多種不同的腫瘤組織中都存在著突變。
Eph受體包括三個結構域:胞外配體結合區、細胞內具酪氨酸激酶活性的功能區和連接這兩個區域的由疏水氨基酸組成的跨膜區。
細胞外結構域包括1個N端球狀結構域(Glb),一個由Sushi結構域和EGF樣結構域一起構成富含半胱氨酸的連接區和兩個纖粘連蛋白Ⅲ型重復區。其中,球狀結構域是與配體結合的關鍵結構域,決定了受體與配體的結合特性,該結構域的突變可破壞抗EphA3單克隆抗體結合受體的能力。
胞內區包括具酪氨酸激酶活性的結構域、SAM結構域(Sterile α-motif domain)和PDZ結構域[7]。其中具有酪氨酸激酶活性的結構域包含近膜區域(兩個參與Eph激酶活化的酪氨酸殘基位于該區域上)和與之緊鄰的激酶區域。激酶結構域的激活環內有激酶活化所需的第三個酪氨酸殘基。
SAM結構域在Eph蛋白家族中高度保守,SAM結構中的酪氨酸殘基是使受體信號分子聚集的必需位點[8]。SAM結構域去除降低了EphA3突變體形成二聚體的能力,其磷酸化水平和激酶活性均受到影響[9]。
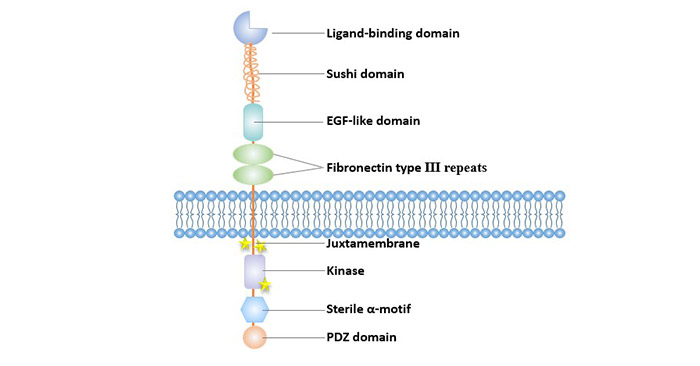
圖1. Eph受體的結構
3. EphA3配體
EphA3的配體是:Ephrin-B2和Ephrin-A5。Ephrin配體依據與細胞膜附著方式的不同分為Ephrin-A和Ephrin-B兩個亞型。通過糖基磷脂酰肌醇鏈錨定在細胞膜上的稱為Ephrin-A亞型,共5種,Ephrin-B類配體共3種,屬于單次跨膜蛋白,由細胞內結構、跨膜部分和細胞外結構組成。
Eph家族配體只有膜附著形式具有活性,可溶形式不僅無活性實際還起拮抗劑作用。
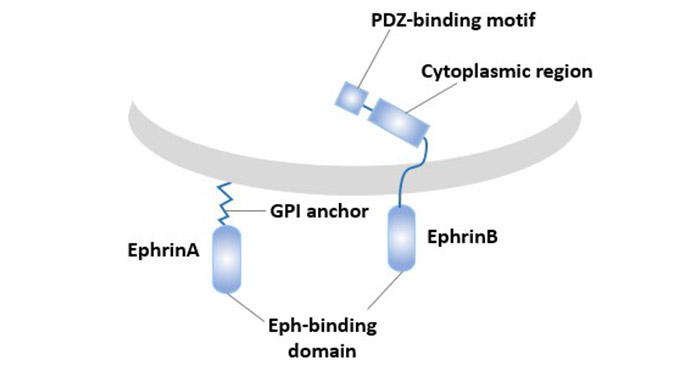
圖2. Eph家族配體的類型和結構
4. EphA3表達
EphA3在大腦和脊髓,肺,腎,心臟和肌肉組織的胚胎發育的各個階段高度表達[10]。在正常成人組織中EphA3幾乎不存在,并且在中樞神經系統(CNS)中稀疏表達[11],在視網膜中表達相對較高,在膀胱,前列腺,子宮和心臟中的表達較少[12]。
EphA3在胃癌、肺癌、腎癌、結腸癌、黑色素瘤、肉瘤、膽管癌[13]、前列腺癌[14]等實體腫瘤中異常表達,并且與腫瘤的侵襲轉移相關[15]。此外,EphA3在一些造血系統腫瘤和淋巴細胞腫瘤中存在著過度表達[16]。
5. EphA3功能
Eph-ephrin介導的細胞通訊控制著細胞的生物學功能,如細胞的附著和脫離、細胞的形狀和運動。
EphA3受體活性控制細胞-細胞粘附和收縮反應。細胞-細胞黏附/脫黏附的調節主要通過蛋白水解酶進行調控。蛋白水解破壞EphA3依賴的細胞-細胞相互作用。其中,跨膜金屬蛋白酶ADAM10是細胞與細胞接觸時調控信號傳遞的主要蛋白酶之一,它對EphA/ephrin-A細胞間相互作用的破壞至關重要。ADAM10富含半胱氨酸的結構域中有一個底物結合口袋,該口袋專門識別EphA3/ephrin-A5復合物,定位蛋白酶結構域,將ephrin從相鄰細胞膜上分離。
酪氨酸激酶Eph受體及配體在正常細胞黏附、遷移、血管生成中發揮重要的作用,研究表明Eph受體或ephrin蛋白在維持血管、腎臟及腸道等組織的結構上發揮著一定的作用[17]。此外,它們還和許多腫瘤血管的形成密切相關,并被認為參與腫瘤的侵襲和轉移。
5.1 EphA3在發育中的作用
Eph-ephrin通過調節細胞-細胞粘附和去粘附來控制正常和致癌發育過程中的細胞定位,從而影響細胞發育。Eph/ephrin信號在多個發育過程中被使用,從原腸胚形成和體細胞生成,到血管和神經系統的模式。
Ephs對胚胎學過程至關重要,尤其是神經系統的發育。例如EphA3在視網膜頂蓋發育(retinotectal development)[18]中發揮著重要的作用,這與EphA3在人類視網膜中的高表達保持一致。
5.2 EphA3與癌癥
EphA3在多種腫瘤中表達,它與腫瘤干細胞和血管生成有關。
5.2.1 EphA3與實體瘤
EphA3在癌癥中廣泛突變,在實體腫瘤[19]中發現多達40個突變。許多突變影響Ephrin結合域、sushi-like和EGF-like結構域(都參與配體結合)或激酶結構域,這些結構域的突變可能會導致正向信號轉導的異常。
在黑素瘤發現高EphA3水平。黑色素瘤細胞上的EphA3激活誘導Rho依賴性細胞骨架再組織和細胞回縮,這可能促進腫瘤轉移。
Eph過表達還廣泛存在于間質腫瘤中,包括肉瘤。
骨肉瘤和胃腸道間質瘤以及GBM和其他神經腫瘤中EphA3的表達升高。在一種膠質母細胞瘤(GBM)的間葉細胞亞型中也發現了EphA3的高表達,在這種間葉細胞亞型中,EphA3的表達與干細胞的維持密切相關。
EphA3在上皮性腫瘤也存在過表達,包括肺和腎的腫瘤。EphA3在乳腺癌、肺癌、結直腸癌和胃癌的亞群中均有高表達。研究發現,EphA3在肺癌中的突變率達到了5%-10%,在多組肺癌組織中該基因缺失[20]。過量表達EphA3可以增加小細胞肺癌中腫瘤細胞凋亡率和G0/G1期細胞周期阻滯,從而降低對化療藥物的抵抗[21]。EphA3在肝癌中的表達分布及其作用方面的研究更是只有少數幾例[22]。研究表明,EphA3在肝癌中的表達高低與肝癌的腫瘤大小、腫瘤轉移、分級及存活率密切相關。EphA3在胃癌組織內高表達也已被證實,高水平的EphA3表達與胃癌的血管生成和預后不良有關。
然而,與其他Ephs一樣,關于EphA3在癌癥進展中的作用和表達并不總是一致的。
5.2.2 EphA3與血液惡性腫瘤
EphA3在血液惡性腫瘤中也存在異常表達。與表達EphA3的實體腫瘤相比,EphA3在血液病惡性腫瘤中的結構正常。
研究表明EphA3在骨髓增生性腫瘤中的表達升高,而健康對照組的骨髓和外周血細胞中沒有EphA3。在不同時期,其表達水平存在差異,慢性髓系白血病(CML)患者在慢性期EphA3表達較低,在加速期或變胚期表達明顯升高。
此外,Eph RTKs還參與了許多與惡性腫瘤相關的其他過程,包括腫瘤微環境的改變,這可能促進惡性腫瘤的發生和血管生成。
6. Eph/Ephrin信號傳導
Eph/Ephrin信號傳導通道的概述如下:配體與Eph受體的胞外區域結合后使受體構象發生變化,引起受體在胞膜上遷移、聚集,并形成寡聚化的受體配體復合物,激活胞漿的酪氨酸激酶而活化,導致自身磷酸化及下游大量胞內底物蛋白質分子的酪氨酸磷酸化,啟動不同信號途徑將信號逐級傳遞。
Eph-ephrin相互作用的一個顯著特征是雙向信號傳導的現象,即Eph/Ephrin信號傳導通道的特點是不僅作用于表達Eph細胞(正向信號),而且作用于表達Ephrin細胞(逆向信號),且正反向信號均可通過酪氨酸磷酸化依賴或非依賴傳導途徑進行傳導。
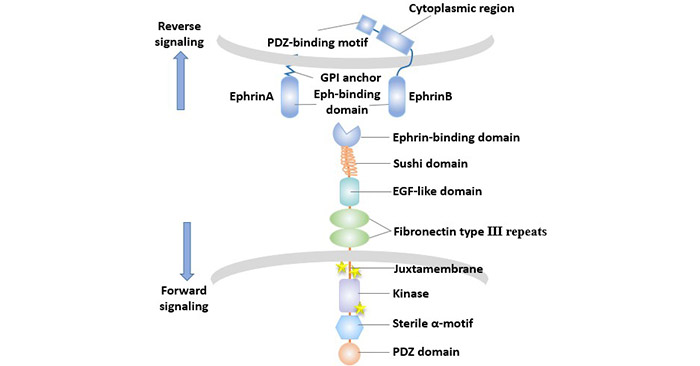
圖3. Eph/Ephrin信號的雙向傳導
形成信號簇(最小四聚體)而不是受體二聚,是Eph-ephrin信號傳導的關鍵要求。ephrin配體的聚類(Clustering)對于Eph信號傳遞是必要的,膜結合或成簇的ephrin刺激Eph活性,而可溶性的ephrins抑制Eph活性。例如,單體ephrin-A5可拮抗EphA3的活化[23]。
Ephrin結合導致三個主要酪氨酸的磷酸化-近膜區域中的Y596和Y602以及激酶活化環中的Y779,隨后激酶結構域激活。CrkII適配蛋白被招募到活化的激酶域,對隨后的信號級聯至關重要,從而導致RhoA GTPases的活化。
Eph RTKs通過調節Rho或Ras家族GTP酶的活化狀態來靶向細胞骨架以改變細胞粘附/排斥和細胞運動性質[24]。
Rho家族GTPases作為Eph受體的下游信號分子,它的激活使Rho家族內的平衡轉移到優先激活RhoA,抑制Rac1和Cdc42。Rac1/cdc42促進細胞運動,促進遷移細胞中板足和絲狀足的形成,而RhoA抑制細胞運動。這使得細胞的運動特性改變。
Eph除了可介導細胞骨架結構的變化,還可以基于Eph RTK磷酸化狀態促進或抑制存活途徑。
7. EphA3靶向治療
Eph受體酪氨酸激酶在正常和致癌發育過程中控制細胞-細胞相互作用,并涉及一系列過程,包括血管生成,干細胞維持和轉移。Eph基因在腫瘤進展的各種機制中發揮作用,因此,它們可作為癌癥治療的靶點。
鑒于EphA3和其他Ephs在腫瘤中所起的作用,包括激酶抑制劑的使用在內的Eph抑制劑的開發已經投入了大量的努力。
針對EphA3,Vearing等[25]嘗試利用可溶性EphA3的高黏附性配體EphrinA5來封閉EphA3,從而達到抑制其促進腫瘤生長的功能。
對于EphA3,最主要的治療候選藥物是單克隆抗體IIIA4。IIIA4,是靶向EphA3的IgG1κ單克隆抗體[6]。IIIA4的靶點位于與配體結合位點相鄰的EphA3胞外結構域N端,對EphA3具有較高的親和力。與配體相似,預聚類的IIIA4能有效地觸發EphA3活化,細胞骨架收縮和細胞變圓,而非聚集的IIIA4也在體外加強配體激活。
利用抗體人工工程技術對IIIA4進行了改造,制備出KB004,目前已進入臨床開發階段。KB004可能會改變微環境,使其不利于腫瘤生長和增殖。KB004對EphA3保持高親和力,具有強大的抗體依賴性細胞毒性(ADCC)。KB004目前正在血液病惡性腫瘤患者的I/II期臨床試驗中進行評估(ClinicalTrials.gov標識符:NCT01211691)。
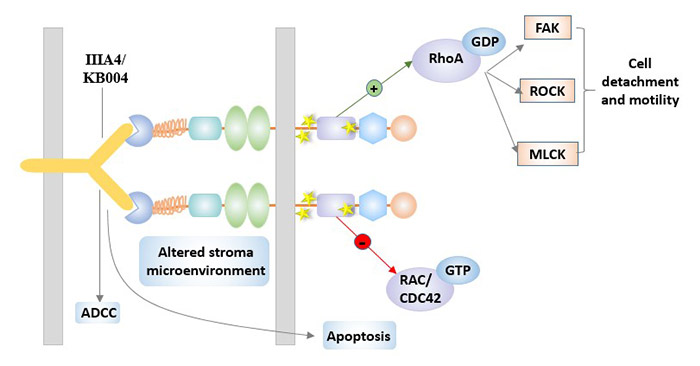
圖4. IIIA4 / KB004在EphA3靶向治療中的作用
為鼎力協助科研和藥企人員針對EphA3的在腫瘤中的臨床應用研究,CUSABIO推出EphA3活性蛋白(Code:CSB-MP007723HU),助力您在EphA3機制方面的研究或其潛在臨床價值的探索。
華美 CUSABIO EphA3 蛋白
Recombinant Human Ephrin type-A receptor 3 (EPHA3), partial (Active) Code: CSB-MP007723HU
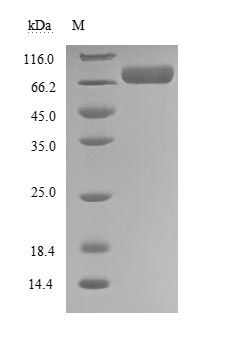
(Tris-Glycine gel) Discontinuous SDS-PAGE (reduced) with 5% enrichment gel and 15% separation gel.
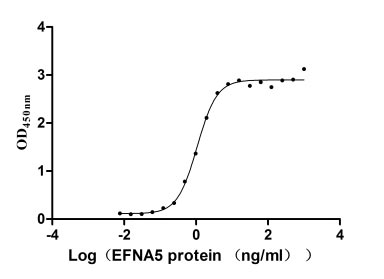
Immobilized EPHA3 at 2 μg/ml can bind human EFNA5(CSB-MP007464HU). The EC50 of the protein is 0.9734-1.179 ng/ml.
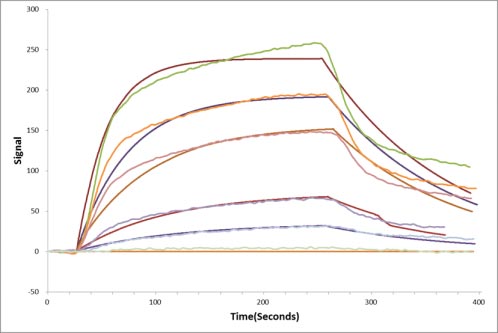
Human EPHA3 protein his tag (CSB-MP007723HU) captured on COOH chip can bind Human EFNA5 protein Fc tag (CSB-MP007464HU) with an affinity constant of 13.8 nM
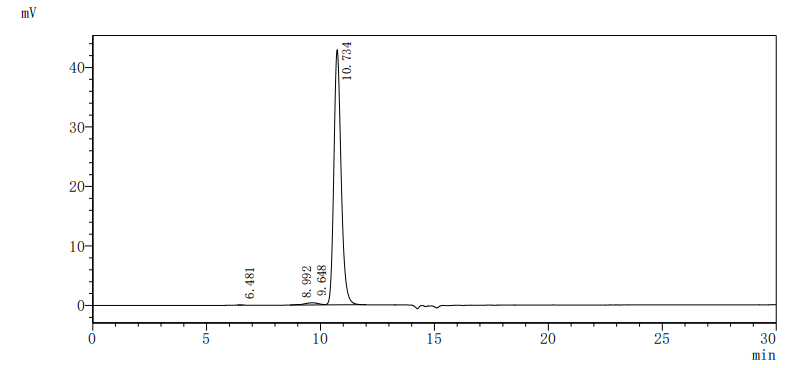
The purity of Human EPHA3 was greater than 95% as determined by SEC-HPLC.
參考文獻:
[1] Birgit M, Bettina R, Christin N, et al. Eph Receptors and Ephrin Ligands: Important Players in Angiogenesis and Tumor Angiogenesis [J]. Journal of Oncology, 2010, 2010: 1-12.
[2] Mélanie H, Schaffner F, Augustin H G. Eph receptor and ephrin ligand-mediated interactions during angiogenesis and tumor progression [J]. Experimental Cell Research, 2006, 312(5): 642-650.
[3] Xi H Q, Wu X S, Wei B, et al. Aberrant expression of EphA3 in gastric carcinoma: correlation with tumor angiogenesis and survival [J]. Journal of Gastroenterology, 2012, 47(7): 785-794.
[4] Hirai H, Maru Y, Hagiwara K, et al. A novel putative tyrosine kinase receptor encoded by the eph gene [J]. Science, 1987, 238(4834): 1717-1720.
[5] Committee E N. Unified nomenclature for Eph family receptors and their ligands, the ephrins. Eph Nomenclature Committee [J]. Cell, 1997, 90(3): 403.
[6] Boyd A W, Ward L D, Wicks I P, et al. Isolation and characterization of a novel receptor-type protein tyrosine kinase (hek) from a human pre-B cell line [J]. Journal of Biological Chemistry, 1992, 267(5): 3262-3267.
[7] Pasquale, Elena B. Developmental Cell Biology: Eph receptor signalling casts a wide net on cell behavior [J]. Nat Rev Mol Cell Biol, 2005, 6(6): 462-475.
[8] Stein E, Lane A A, Cerretti D P, et al. Eph receptors discriminate specific ligand oligomers to determine alternative signaling complexes, attachment, and assembly responses [J]. Genes & Development, 1998, 12(5): 667-78.
[9] Singh D R, Cao Q, King C, et al. Unliganded EphA3 dimerization promoted by the SAM domain [J]. Biochemical Journal, 2015, 471(1): 101-109.
[10] Kilpatrick T J, Brown A, Lai C, et al. Expression of theTyro4/Mek4/Cek4Gene Specifically Marks a Subset of Embryonic Motor Neurons and Their Muscle Targets [J]. Molecular and Cellular Neuroscience, 1996, 7(1): 62-74.
[11] Hafner C, Schmitz G, Meyer S, et al. Differential Gene Expression of Eph Receptors and Ephrins in Benign Human Tissues and Cancers [J]. Clinical Chemistry, 2004, 50(3): 490-499.
[12] Chiari R, Gérald Hames, Stroobant V, et al. Identification of a Tumor-specific Shared Antigen Derived From an Eph Receptor and Presented to CD4 T Cells on HLA Class II Molecules [J]. Cancer Research, 2000, 60(17): 4855-63.
[13] Suksawat M, Techasen A, Namwat N, et al. Upregulation of endothelial nitric oxide synthase (eNOS) and its upstream regulators in Opisthorchis viverrini associated cholangiocarcinoma and its clinical significance [J]. Parasitology International, 2016: S1383576916300976.
[14] Hood G, Laufer-Amorim R, Fonseca-Alves C E, et al. Overexpression of Ephrin A3 Receptor in Canine Prostatic Carcinoma [J]. Journal of Comparative Pathology, 2016: S0021997516000037.
[15] Xi H Q, Zhao P. Clinicopathological significance and prognostic value of EphA3 and CD133 expression in colorectal carcinoma [J]. Journal of Clinical Pathology, 2011, 64(6): 498-503.
[16] Wicks I P, Wilkinson D, Boyd E S W. Molecular Cloning of HEK, the Gene Encoding a Receptor Tyrosine Kinase Expressed by Human Lymphoid Tumor Cell Lines [J]. Proceedings of the National Academy of Sciences of the United States of America, 1992, 89(5): 1611-1615.
[17] Ogawa K. EphB2 and ephrin-B1 expressed in the adult kidney regulate the cytoarchitecture of medullary tubule cells through Rho family GTPases [J]. Journal of Cell Science, 2006, 119(3): 559-570.
[18] Feldheim D A. Loss-of-Function Analysis of EphA Receptors in Retinotectal Mapping [J]. Journal of Neuroscience, 2004, 24(10): 2542-2550.
[19] Lisabeth E M, Fernandez C, Pasquale E B. Cancer Somatic Mutations Disrupt Functions of the EphA3 Receptor Tyrosine Kinase through Multiple Mechanisms [J]. Biochemistry, 2012, 51(7): 1464-1475.
[20] Zhuang G, Song W, Amato K, et al. Effects of Cancer-Associated EphA3 Mutations on Lung Cancer [J]. JNCI Journal of the National Cancer Institute, 2012, 104(15): 1183-1198.
[21] Peng J, Wang Q, Liu H, et al. EphA3 regulates the multidrug resistance of small cell lung cancer via the PI3K/BMX/STAT3 signaling pathway [J]. Tumor Biology, 2016, 37(9): 11959-11971.
[22] Tao Kai-Shan. High levels of EphA3 expression are associated with high invasive capacity and poor overall survival in hepatocellular carcinoma [J]. Oncology Reports, 2013, 30(5).
[23] Lawrenson I D, Wimmerkleikamp S H, Lock P, et al. Ephrin-A5 induces rounding, blebbing and de-adhesion of EphA3-expressing 293T and melanoma cells by CrkII and Rho-mediated signaling [J]. Journal of Cell Science, 2002, 115(Pt 5): 1059.
[24] Pasquale E B. Eph-Ephrin Bidirectional Signaling in Physiology and Disease [J]. Cell, 2008, 133(1): 0-52.
[25] Vearing C. Concurrent Binding of Anti-EphA3 Antibody and Ephrin-A5 Amplifies EphA3 Signaling and Downstream Responses: Potential as EphA3-Specific Tumor-Targeting Reagents [J]. Cancer Research, 2005, 65(15): 6745-6754.
下一篇: 卵巢癌--沉默的殺手










